本试题 “某种胃药中抗酸剂为CaCO3.甲、乙两同学为测定其中CaCO3含量,分别设计以下两种方案(药片中的其它成分与HCl和NaOH溶液均不反应).请回答下列有关问题:(1...” 主要考查您对测定物质组成、成分含量
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 测定物质组成、成分含量
定量实验介绍:

燃烧法测定氨基酸的组成:
实验室用燃烧法测定某种氨基酸(CxHyOzNp)的分子组成。取Wg该种氨基酸放在纯氧中充分燃烧,生成CO2、H2O和N2。现按下图所示装置进行实验。

①实验开始时,首先要通入一段时间的氧气,目的是排除体系中的N2。
②D装置的作用是吸收未反应的O2,保证最终收集的气体是N2。
③读取N2体积时,应注意:量筒内液面与广口瓶中的液面相持平视线与凹液面最低处相切。
④实验中测得N2的体积为VmL(已折算为标准状况)。为确定此氨基酸的分子式,还需要的有关数据为生成二氧化碳气体的质量、生成水的质量、氨基酸的相对分子质量
用氨气还原氧化铜的方法测定铜的近似相对原子质量:
实验室用氨气还原氧化铜的方法测定铜的近似相对原子质量,反应的化学方程式为:2NH3+3CuO
 N2+3Cu+3H2O
N2+3Cu+3H2O(1)如果选用测定反应物CuO和生成物H2O的质量[m(CuO)、m(H2O)]时,请用下列仪器设计一个简单的实验方案。
装置图:
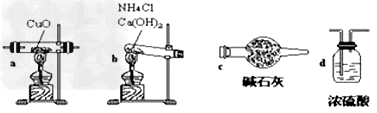
①连接顺序为:bcacd
②d中浓硫酸的作用是吸收未反应的氨、防止空气中水分进入;实验完毕时观察到a中的现象是固体由黑色转变为红色;
③Cu的相对原子质量的表达式
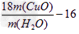
发现相似题
与“某种胃药中抗酸剂为CaCO3.甲、乙两同学为测定其中CaCO3含量...”考查相似的试题有:
- 硫酸亚铁晶体(FeSO4•7H2O)在医药上作补血剂.某课外小组测定该补血剂中铁元素的含量.实验步骤如下:请回答下列问题:(1)...
- 在硫酸铜晶体(CuSO4•n H2O)结晶水含量测定的操作中,导致n值偏小的是( ) A.晶体未研成粉末 B.坩埚未干燥 C.加热过程中...
- 某课外小组欲通过实验证明方铅矿分解所得白色粉末中含有氧元素,设计以下的实验装置:在实验或改进实验中,可能发生的化学反...
- 在走访调查中,小红观察到某乡镇颜料厂排出的废水带有颜色,经鉴定含有铅。为了测定废水中铅的浓度,他设计了如下实验步骤(1...
- 选用下图所示仪器组合一套町用来测定过氧化钠与水反应生成氧气体积的装置,其合理的连接顺序是A. l -2 -3 -4 -5 -7B. l -2 -3...
- 三氯化铬是化学合成中的常见物质,三氯化铬易升华,在高温下能被氧气氧化,碱性条件下能被H2O2氧化为Cr(Ⅵ).制三氯化铬的流...
- 实验室有一瓶亚硫酸钠试剂,有部分己被氧化成硫酸钠.某学生设计了下列实验来测定其中Na2SO4的质量分数.(已知:2HCl+Na2SO3...
- 为测定某钢样组成,现取某钢样粉末28.12g(假设只含Fe和C),在氧气流中充分反应,得到CO2气体224mL(标准状况).(1)计算...
- 已知酸性条件下有反应:2Cu+═Cu2++Cu.氢气还原氧化铜实验由于反应温度不同,可能产生Cu或Cu2O,两者都是红色固体.某同学对...
- 实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4++6HCHO==3H++6H2O+(CH2)6N4H+[滴定时,1mol(CH2)6N...