本试题 “关于下列各图的叙述,正确的是[ ]A.甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6kJ·mol-lB.乙表示恒温恒容条件下发生的可逆反应2NO2N2O4(...” 主要考查您对溶解度
燃烧热
影响化学平衡的因素
弱电解质的电离
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 溶解度
- 燃烧热
- 影响化学平衡的因素
- 弱电解质的电离
溶解度:
(1)固体物质的溶解度:在一定温度下,某固态物质在100克溶剂里达到饱和状态时所溶解的质量,单位是g,符号用S表示。
表达式: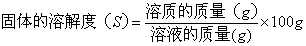
(2)气体的溶解度定义:指该气体在压强为101kPa,一定温度时,溶解在1体积水中达到饱和状态时气体的体积。
溶解度曲线:
- 溶解度曲线由于固体物质的溶解度随温度变化而变化,这种变化可以用溶解度曲线来表示。我们用纵坐标表示溶解度,横坐标表示温度,绘出固体物质的溶解度随温度变化的曲线,这种曲线叫做溶解度曲线。
- 溶解度曲线的意义:
①溶解度曲线上的点表示物质在该点所示温度下的溶解度,溶液所处的状态是饱和溶液。
②溶解度曲线下面的面积上的点,表示溶液所处的状态是不饱和状态,依其数据配制的溶液为对应湿度时的不饱和溶液。
③溶解度曲线上面的面积上的点,依其数据配制的溶液为对应温度时的饱和溶液,且该溶质有剩余。
④两条溶解度曲线的交点,表示在该点所示的温度下,两种物质的溶解度相等。
溶解度的影响因素:
- 固体物质溶解度的影响因素:溶质,溶剂的种类,温度
- 气体物质溶解度的影响因素:溶质,溶剂的种类,温度,压强
溶解度与温度的关系:
(1)固体物质的溶解度一般随温度的升高而增大,个别物质反常,如Ca(OH)2。
(2)气体物质的溶解度,一般随温度升高而减小,随压强增大而增大。常见的可溶性气体(常温、常压时的体积数):NH3 (700),HCl(0℃时500),HBr、HI亦易溶,SO2(40),C12 (2).H2S(2.6),CO2(1)。难溶气体:H2、CO、NO。有机物中:HCHO易溶,C2H2微溶,CH4、C2H4难溶。
a.大部分固体物质的溶解度随温度的升高而增大,如KNO3、NaNO3等。
b.少数固体物质的溶解度受温度影响很小,如 NaCl。
c.极少数固体物质的溶解度随温度的升高而减小,如 Ca(OH)2
饱和溶液与不饱和溶液、过饱和溶液:
过饱和溶液:一定温度、压力下,当溶液中溶质的浓度已超过该温度、压力下溶质的溶解度,而溶质仍不析出的现象叫过饱和现象,此时的溶液称为过饱和溶液。
饱和溶液:在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时,所得的溶液叫做这种溶质的饱和溶液。
不饱和溶液:在一定温度下,在一定量的溶剂里,还能再溶解某种物质的溶液叫做这种溶质的不饱和溶液。
溶解度曲线:

溶解度曲线的意义:
①表示同一种物质在不同温度时的溶解度;
②表示不同物质在同一温度时的溶解度,可以比较同一温度时,不同物质的溶解度的大小。若两种物质的溶解度曲线相交,则在该温度下两种物质的溶解度相等;
③根据溶解度曲线可以确定从饱和溶液中析出晶体或进行混合物分离提纯的方法;
④根据溶解度曲线能进行有关的计算。
溶解度曲线变化规律:
1.大多数固体物质的溶解度随湿度升高而增大,曲线为"陡升型",如硝酸钾。
2.少数固体物质的溶解度受湿度的影响很小,曲线为"缓升型",如氯化钠。
3.极少数固体物质的溶解度随湿度的升高而减小,曲线为"下降型",如氢氧化钙。
4.气体物质的溶解度均随湿度的升高而减小(纵坐标表示体积),曲线也为"下降型",如氧气。
溶解度曲线的应用:
1.查找指定温度时物质的溶解度,并根据溶解度判断溶解性。
2.比较相同湿度时(或一定湿度范围内)不同物质溶解度的大小。
3.比较和确定物质的溶解度受温度影响的程度,并据此确定物质结晶或混合物分离提纯的方法。
4.确定溶液的状态(饱和与不饱和)。

溶解度曲线上的点的意义:
①溶解度曲线上的点表示物质在该点所示温度下的溶解度,溶液所处的状态是饱和溶液。
②溶解度曲线下面的面积上的点,表示溶液所处的状态是不饱和状态,依其数据配制的溶液为对应湿度时的不饱和溶液。
③溶解度曲线上面的面积上的点,依其数据配制的溶液为对应温度时的饱和溶液,且该溶质有剩余。
④两条溶解度曲线的交点,表示在该点所示的温度下,两种物质的溶解度相等。
有关溶解度的计算:
某温度下,
在101kPa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热。单位为kJ/mol
燃烧热和中和热的异同:
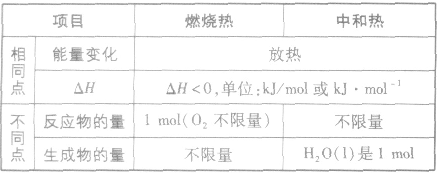
注意事项:
(1)规定是在101kPa 下测出的热量。书中提供的燃烧热数据都是在25℃、101kPa下测定出来的
(2)规定可燃物的物质的量为1mol(这样才有可比性)。因此,表示可燃物的燃烧热的热化学方程式中,可燃物的化学计量数为1,其他物质的化学计量数常出现分数
(3)规定生成稳定的氧化物,例如
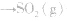 等
等 (4)叙述燃烧热时、不用“+”“-”,在热化学方程式中用△H表示时取“-”
(1)浓度在其他条件不变的情况下,增大反应物的浓度或减小生成物的浓度,都可以使化学平衡向正反应方向移动;增大生成物的浓度或减小反应物的浓度,都可以使化学平衡向逆反应方向移动。
(2)压强对反应前后气体总体积发生变化的反应,在其他条件不变时,增大压强会使平衡向气体体积缩小的方向移动,减小压强会使平衡向气体体积增大的方向移动。对于反应
 来说,加压,
来说,加压,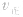 增大、
增大、 增大,
增大,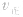 增大的倍数大,平衡向正反应方向移动:若减压,
增大的倍数大,平衡向正反应方向移动:若减压,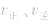 均减小,
均减小,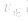 减小的倍数大,平衡向逆反应方向移动,加压、减压后v一t关系图像如下图:
减小的倍数大,平衡向逆反应方向移动,加压、减压后v一t关系图像如下图: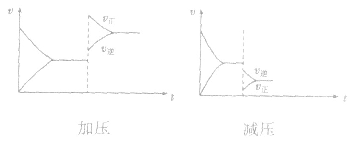
(3)温度在其他条件不变时,温度升高平衡向吸热反应的方向移动,温度降低平衡向放热反应的方向移动
对于
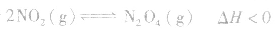 ,加热时颜色变深,降温时颜色变浅。该反应升温、降温时,v—t天系图像如下图:
,加热时颜色变深,降温时颜色变浅。该反应升温、降温时,v—t天系图像如下图: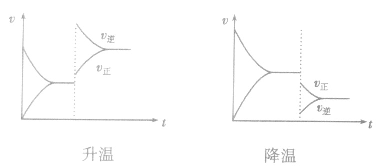
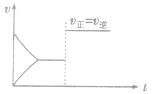
(4)催化剂由于催化剂能同等程度地改变正、逆反应速率,所以催化剂对化学平衡无影响,v一t图像为
稀有气体对化学反应速率和化学平衡的影响分析:
1.恒温恒容时
充入稀有气体
 体系总压强增大,但各反应成分分压不变,即各反应成分的浓度不变,化学反应速率不变,平衡不移动。
体系总压强增大,但各反应成分分压不变,即各反应成分的浓度不变,化学反应速率不变,平衡不移动。 2.恒温恒压时
充入稀有气体
 容器容积增大
容器容积增大 各反应成分浓度降低
各反应成分浓度降低 反应速率减小,平衡向气体体积增大的方向移动。
反应速率减小,平衡向气体体积增大的方向移动。3.当充入与反应无关的其他气体时,分析方法与充入稀有气体相同。
化学平衡图像:
1.速率一时间因此类图像定性揭示了
 随时间(含条件改变对化学反应速率的影响)变化的观律,体现了平衡的“动、等、定、变”的基本特征,以及平衡移动的方向等。
随时间(含条件改变对化学反应速率的影响)变化的观律,体现了平衡的“动、等、定、变”的基本特征,以及平衡移动的方向等。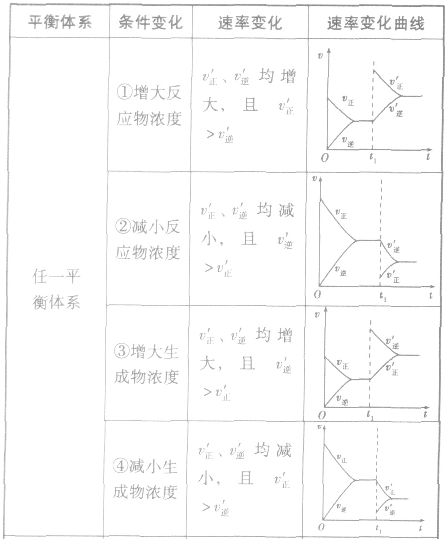
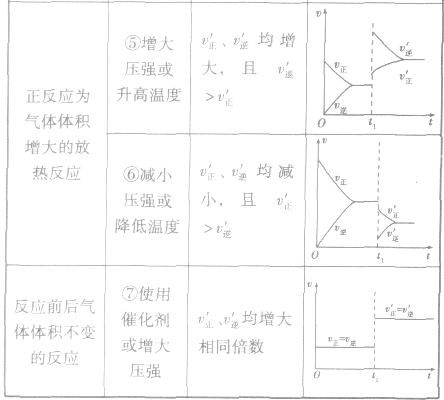
2.含量一时间一温度(压强)图常见的形式有下图所示的几种(C%指某产物百分含量,B%指某反应物百分含量),这些图像的折点表示达到平衡的时间,曲线的斜率反映了反应速率的大小,可以确定T(p)的高低(大小),水平线高低反映平衡移动的方向。

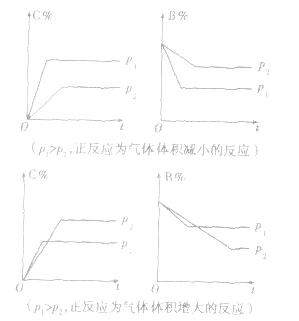
3.恒压(温)线该类图像的纵坐标为物质的平衡浓发(c)或反应物的转化率(α),横坐标为温度(T)或压强 (p),常见类型如下图:
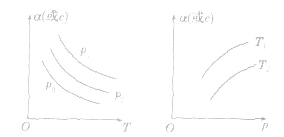
小结:
1.图像分析应注意“三看”
(1)看两轴:认清两轴所表示的含义。
(2)看起点:从图像纵轴上的起点,一般可判断谁为反应物,谁为生成物以及平衡前反应进行的方向。
(3)看拐点:一般图像在拐点后平行于横轴则表示反应达平衡,如横轴为时间,由拐点可判断反应速率。
2.图像分析中,对于温度、浓度、压强三个因素,一般采用“定二议一”的方式进行分析
平衡移动方向与反应物转化率的关系:
1.温度或压强改变引起平衡向正反应方向移动时,反应物的转化率必然增大。
2.反应物用量的改变
(1)若反应物只有一种时,如aA(g)
 bB(g)+ cc(g),增加A的量,平衡向正反应方向移动,但反应物 A的转化率与气体物质的化学计量数有关:
bB(g)+ cc(g),增加A的量,平衡向正反应方向移动,但反应物 A的转化率与气体物质的化学计量数有关:
(2)若反应物不止一种时,如aA(g)+bB(g)
 cC(g)+dD(g):
cC(g)+dD(g): a.若只增加A的量,平衡向正反应方向移动,而A的转化率减小,B的转化率增大。
b.若按原比例同倍数的增加反应物A和B的量,则平衡向正反应方向移动,而反应物的转化率与气体物质的计量数有关:

c.若不同倍增加A、B的量,相当于增加了一种物质,同a。
3.催化剂不改变转化率。
4.反应物起始的物质的量之比等于化学计量数之比时,各反应物转化率相等。
浓度、压强影响化学平衡的几种特殊情况:
1.当反应混合物中存在固体或纯液体物质时,由于其“浓度”是恒定的,不随其量的增减而变化,故改变这些固体或纯液体的量,对平衡基本无影响。
2.南于压强的变化对非气态物质的浓度基本无影响,因此,当反应混合物中不存在气态物质时,压强的变化对平衡无影响。
3.对于气体分子数无变化的反应,如
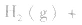
 ,压强的变化对其平衡无影响。这是因为,在这种情况下,压强的变化对正、逆反应速率的影响程度是等同的,故平衡不移动。
,压强的变化对其平衡无影响。这是因为,在这种情况下,压强的变化对正、逆反应速率的影响程度是等同的,故平衡不移动。 4.对于有气体参加的反应,同等程度地改变反应混合物中各物质的浓度,应视为压强对平衡的影响,如某平衡体系中,
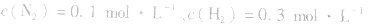 ,
,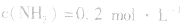 ,当浓度同时增大一倍时,即让
,当浓度同时增大一倍时,即让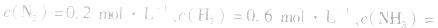
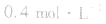 ,此时相当于压强增大一倍,平衡向生成NH3的方向移动。
,此时相当于压强增大一倍,平衡向生成NH3的方向移动。 5.在恒容的密闭容器中,当改变其中一种气体物质的浓度时,必然同时引起压强改变,但判断平衡移动的方向时,心仍从浓度的影响去考虑:如
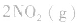
 ,平衡后,向容器中再通入反应物
,平衡后,向容器中再通入反应物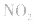 ,使 c(NO2)增大,平衡正向移动;如向容器中再通入生成物 N2O4,则使c(N2O4)增大,平衡逆向移动。但由于两种情况下,容器内的压强都增大,故对最终平衡状态的影响是一致的,如两种情况下,重新达到平衡后,NO2的百分含量都比原平衡时要小
,使 c(NO2)增大,平衡正向移动;如向容器中再通入生成物 N2O4,则使c(N2O4)增大,平衡逆向移动。但由于两种情况下,容器内的压强都增大,故对最终平衡状态的影响是一致的,如两种情况下,重新达到平衡后,NO2的百分含量都比原平衡时要小在一定温度、浓度的条件下,弱电解质在溶液中电离成离子的速率与离子结合成分子的速率相等时,电离过程就到了电离平衡状态,叫弱电解质的电离平衡。

电离平衡的特征:
(1)等:

(2)动:
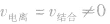 的动态平衡
的动态平衡(3)定:条件一定,分子与离子浓度一定。
(4)变:条件改变,平衡破坏,发生移动。
与“关于下列各图的叙述,正确的是[ ]A.甲表示H2与O2发生反应过...”考查相似的试题有:
- 盖斯定律认为:不管化学过程是一步或分为数步完成,这个过程的热效应是相同的。已知:H2O(g)= H2O(l) △H1=-Q1kJ·mol-...
- 将2 mol A和1 mol B充入一个密闭容器中,在一定条件下发生:2A(g)+B(g)xC(g)达到平衡,测得C的物质的量分数为c%;若开始...
- 附加题:2molSO21molO2在一定条件反应:2SO2(g)+O2(g)⇌2SO3(g)△H<0.若:恒温恒容条件下SO2的转化率为a%;恒温恒压条...
- (10分)工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有...
- 如图Ⅰ恒压密闭容器,Ⅱ恒容密闭容器.其它条件相同时,在Ⅰ、Ⅱ中分别加入3molZ,起始时容器体积均为VL,发生如下反应3X(?)+2...
- 对于密闭容器中的可逆反应:mX(g)+nY(s)⇌pZ(g);△H<0,达化学平衡后,改变条件,下列表述不正确的是( )A.增大压强...
- T℃时,有甲、乙两个密闭容器,甲容器的体积为1L,乙容器的体积为2L,分别向甲、乙两容器中加入6molA和3molB ,发生了如下反应:3A...
- 在四个相等容积的密闭容器中各自进行如下反应:2SO2(g)+O2(g)2SO3(g) △H
- (12 分)(每空2分)CH3COOH是中学化学中常用的一元弱酸,请回答下列问题:(1)若分别将pH=2的盐酸和醋酸稀释100倍,则稀释...
- 电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点。下图是用KOH溶液分别滴定HCl溶液...