本试题 “实验室欲制取少量NaHCO3与NH4Cl。实验步骤如下请回答:(1)为了制取I、Ⅲ中需用的氨气,某同学设计了如图1 所示装置试简述将浓氨水滴入锥形瓶中的操作:_______...” 主要考查您对碳酸氢钠
铵盐
其他物质的制备(硫酸铜晶体、铁红等)
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 碳酸氢钠
- 铵盐
- 其他物质的制备(硫酸铜晶体、铁红等)
碳酸氢钠(NaHCO3):
(1)俗名:小苏打;细小白色晶体,溶解度小于Na2CO3,受热易分解,可用于治疗胃酸过多、发酵剂
(2)与H+反应:HCO3-+H+==CO2↑+H2O
(3)与NaOH反应:HCO3-+OH-==CO32-+H2O
(4)与石灰水反应:生成CaCO3沉淀
(5)与BaCl2和CO2不反应
碳酸氢钠的物理性质:
碳酸氢钠为白色晶体,或不透明单斜晶系细微结晶。比重2.15g。无臭、味咸,可溶于水,不溶于乙醇。其水溶液因水解而呈微碱性,常温中性质稳定,受热易分解,在50℃以上迅速分解,在270℃时完全失去二氧化碳,在干燥空气中无变化,在潮湿空气中缓慢分解。溶解度:7.8g,18℃;16.0g,60℃。
碳酸氢钠的用途:
碳酸氢钠可直接作为制药工业的原料,用于治疗胃酸过多。
Na2CO3、NaHCO3的性质比较:
| 表示 | 名称 | 碳酸钠 | 碳酸氢钠 |
| 化学式 | Na2CO3 | NaHCO3 | |
| 俗称 | 苏打 | 小苏打 | |
| 物理性质 | 色态 | 白色粉末 | 白色晶体 |
| 溶解性 | 易溶于水 | 能溶于水 | |
| 化学性质 | 与盐酸反应 | Na2CO3+2HCl=2NaCl+H2O+CO2↑ | NaHCO3+HCl=NaCl+H2O+CO2↑ |
| 热稳定性 | 很稳定 | 受热分解:2NaHCO3=(加热)=Na2CO3+H2O+CO2↑ | |
| 与NaOH反应 | 不反应 | NaHCO3+NaOH=Na2CO3+H2O | |
| 相互转化 | Na2CO3+H2O+CO2=2NaHCO3 | NaHCO3+NaOH=Na2CO3+H2O 2NaHCO3=(加热)=Na2CO3+H2O+CO2↑ |
Na2CO3、NaHCO3的鉴别:

Na2CO3、NaHCO3与足量盐酸反应的比较:
碳酸钠、碳酸氢钠与盐酸反应的基本图像的归纳总结:
(1)向Na2CO3中逐滴加入盐酸,消耗HCl的体积与产生CO2的体积的关系如图1所示;
(2)向NaHCO3中逐滴加入盐酸,消耗HCl的体积与产生CO2的体积的关系如图2所示;
(3)向NaOH、Na2CO3的混合物中逐滴加入盐酸,消耗HCl的体积与产生CO2的体积的关系如图3所示(设NaOH、Na2CO3的物质的量之比x∶y=1∶1,其他比例时的图像略);
(4)向Na2CO3、NaHCO3的混合物中逐滴加入盐酸,消耗HCl的体积与产生CO2的体积的关系如图4所示(设Na2CO3、NaHCO3的物质的量之比m∶n=1∶1,其他比例时的图像略)。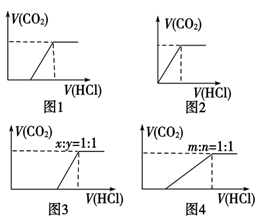
定义:
铵盐是由铵根离子(NH4+)和酸根离子组成的化合物。铵盐都是晶体,都易溶于水。
铵盐的物理性质和化学性质:
(1)物理性质:铵盐是由铵离子(NH4+)和酸根阴离子组成的化合物,铵盐都是白色晶体,都易溶于水。
(2)铵盐的化学性质:
①受热分解:固态铵盐受热都易分解,根据组成铵盐的酸根阴离子对应的酸的性质的不同,铵盐分解时有以下三种情况:
A. 组成铵盐的酸根阴离子对应的酸是非氧化性的挥发性酸时,则加热时酸与氨气同时挥发,冷却时又重新化合生成铵盐。例如:
 (试管上端又有白色固体附着)。
(试管上端又有白色固体附着)。又如:
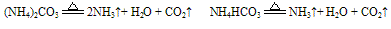
B. 组成铵盐的酸根阴离子对应的酸是难挥发性酸,加热时则只有氨气逸出,酸或酸式盐仍残留在容器中。如:
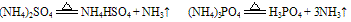
C. 组成铵盐的酸根阴离子对应的酸是氧化性酸,加热时则发生氧化还原反应,无氨气逸出。例如:
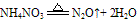
②跟碱反应--铵盐的通性。
固态铵盐+强碱(NaOH、KOH)
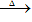 无色、有刺激性气味的气体
无色、有刺激性气味的气体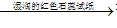 试纸变蓝色。例如:
试纸变蓝色。例如: 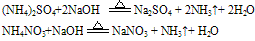
说明:a.若是铵盐溶液与烧碱溶液共热,则可用离子方程式表示为:

b.若反应物为稀溶液且不加热时,则无氨气逸出,用离子方程式表示为:
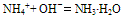
c.若反应物都是固体时,则只能用化学方程式表示。
(3)氮肥的存放和施用.铵盐可用作氮肥.由于铵盐受热易分解,因此在贮存时应密封包装并存放在阴凉通风处;施用氮肥时应埋在土下并及时灌水,以保证肥效。
(1)反应原理:CH3COONa+NaOH
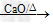 CH4+Na2CO3
CH4+Na2CO3(2)发生装置:固+固
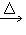 气
气 (3)净化方法:浓硫酸(除水蒸气)
(4)收集方法:排水集气法/向下排空气法
(5)尾气处理:无
(6)检验方法:①点燃,淡蓝色火焰,燃烧产物是H2O和CO2
实验室制取一氧化氮(NO):
(1)反应原理:3Cu+8HNO3(稀)==3Cu(NO3)2+2NO↑+4H2O
(2)发生装置:固+液→气
(3)净化方法:浓硫酸(除水蒸气)
(4)收集方法:排水集气法
(5)尾气处理:收集法(塑料袋)
(6)检验方法:无色气体,暴露于空气中立即变为红棕色
实验室制取二氧化氮(NO2):
(1)反应原理:Cu+4HNO3(浓)==Cu(NO3)2+2NO2↑+2H2O
(2)发生装置:固+液→气
(3)净化方法:浓硫酸(除水蒸气)
(4)收集方法:向上排空气法
(5)尾气处理:碱液吸收 (3NO2+H2O==2HNO3+NO;NO+NO2+2NaOH===2NaNO2+H2O)
实验室制取氯化氢(HCl):
(1)反应原理:2NaCl+H2SO4
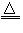 Na2SO4+2HCl?
Na2SO4+2HCl?(2)发生装置:固+液→气
(3)净化方法:浓硫酸(除水蒸气)
(4)收集方法:向上排空气法
(5)尾气处理:水(防倒吸装置)
(6)检验方法:①能使湿润的蓝色石蕊试纸变红 ②靠近浓氨水冒白烟
五水硫酸铜的制备:
(1)实验原理:铜是不活泼金属,不能直接和稀硫酸发生反应制备硫酸铜,必须加入氧化剂。在浓硝酸和稀硫酸的混合液中,浓硝酸将铜氧化成Cu2+,Cu2+与SO42-结合得到硫酸铜: Cu+2HNO3+H2SO4====CuSO4+2NO2+2H2O 未反应的铜屑(不溶性杂质)用倾滗法除去。利用硝酸铜的溶解度在0~100℃范围内均大于硫酸铜溶解度的性质,溶液经蒸发浓缩析出硫酸铜,经过滤与可溶性杂质硝酸铜分离,得到粗产品。硫酸铜的溶解度随温度升高而增大,可用重结晶法提纯。在粗产品硫酸铜中,加适量水,加热成饱和溶液,趁热过滤除去不溶性杂质。滤液冷却,析出硫酸铜,过滤,与可溶性杂质分离,得到纯的硫酸铜。
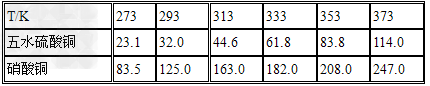
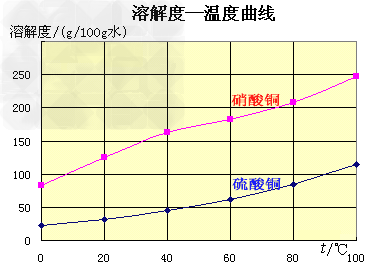
(2)实验步骤
①称量1.5g铜屑,灼烧至表面呈现黑色,冷却;
②加5.5mL3mol/L硫酸,2.5mL浓硝酸,反应平稳后水浴加热,补加2.5mL3mol/L硫酸,0.5mL浓硝酸;
③铜近于完全溶解后,趁热倾滗法分离;
④水浴加热,蒸发浓缩至结晶膜出现;
⑤冷却、过滤;
⑥粗产品以1.2mL水/g的比例,加热溶于水,趁热过滤;
⑦滤液冷却、过滤、晾干,得到纯净的硫酸铜晶体。
⑧称重,计算产率。
实验室制取硫化氢(H2S):
(1)反应原理:FeS+2HCl→H2S↑+FeCl2
(2)发生装置:固+液→气(启普发生器)
(3)净化方法:饱和NaHS(除HCl),固体CaCl2(除水蒸气)
(4)收集方法:向上排空气法
(5)尾气处理:CuSO4溶液或碱液吸收(H2S+2NaOH==Na2S+H2O或H2S+NaOH==NaHS+H2O)
(6)检验方法:①湿润的蓝色石蕊试纸变红 ②湿润的醋酸试纸黑
与“实验室欲制取少量NaHCO3与NH4Cl。实验步骤如下请回答:(1)为...”考查相似的试题有:
- 由短周期元素组成的中学常见无机物A、B、C、D、E、 X存在如下图转化关系(部分生成物和反应条件略去).下 列推断不正确的是[ ]...
- 下列叙述中正确的是[ ]A.向含有CaCO3沉淀的水中通入CO2至沉淀恰好溶解,再向溶液中加入NaHCO3饱和溶液,又有CaCO3沉淀生成B...
- 五种短周期元素A、B、C、D、E的原子序数依次增大。A、B、C三种元素原子核外电子层数之 和是5。A、B两元素原子最外层电子数之...
- 下列制取气体的方案,可以直接采用如图所示装置进行的有( )①用H2O2和MnO2制取O2②用CaCO3和稀盐酸制取CO2③用KClO3和MnO2制取O2...
- 下图正确的是
- (14分)二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。实验室以NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料...
- (11分)某校化学实验兴趣小组欲采用如图所示的实验装置制备Cl2,同时进行与氯气有关的某些实验,按要求回答问题。(1)A是浓...
- 过碳酸钠(Na2CO3·3H2O2),有固体双氧水的俗称,该晶体具有Na2CO3和H2O2的双重性质,被大量应用于洗涤、印染、纺织、造纸、...
- 实验室制取少量溴乙烷的装置如图所示。根据题意完成下列填空:(1)圆底烧瓶中加入的反应物是溴化钠、 和1:1的硫酸。配制体积...
- 利用下图装置(瓶口向上)不可行的实验是A.A口进气,B口排气,用于收集H2B.广口瓶中充满水,从A口进气用于收集O2C.广口瓶...