本试题 “废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。(1)下列处理印刷电路板非金属粉末的方法中...” 主要考查您对离子方程式
盖斯定律
影响化学反应速率的因素
垃圾资源处理
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 离子方程式
- 盖斯定律
- 影响化学反应速率的因素
- 垃圾资源处理
用实际参加反应的离子符号表示离子反应的式子。
离子方程式书写规则:
①写:写出化学反应方程式
②拆:把易溶于水、易电离的物质写成离子形式,难容难电离的物质及气体等仍用化学式表示
③删:删去方程式两边不参加反应的离子
④查:检查离子方程式两边各元素的原子个数和电荷总数是否相等
离子方程式书写及正误的判断方法:
①判断反应是否在水溶液中进行
因为电解质在水溶液中可以电离为自由移动的离子,在这种条件下才能发生离子反应。
②判断反应能否发生。
如果反应不能发生,当然也就没有离子方程式可言。
③判断反应物、生成物是否正确。
④判断质量和电荷是否守恒。
离子方程式不仅要质量守恒,而且反应前后各离子所带电荷总数必须相等。
⑤判断氧化物、难溶物、气体、单质、难电离的弱酸、弱碱、水是否写成了分子形式,而易电离的物质是否写成离子形式。
⑥判断连接符号“=”和“
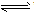 ”及状态符号“↑”和“↓”运用是否正确。
”及状态符号“↑”和“↓”运用是否正确。 强电解质的电离、不可逆反应、双水解反应用“=”;弱电解质电离、可逆反应、水解反应用“
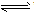 ”。复分解反应、水解反应生成的难溶物用“↓”,气体用“↑”;单水解反应生成的难溶物不用“↓”,气体不用“↑”。
”。复分解反应、水解反应生成的难溶物用“↓”,气体用“↑”;单水解反应生成的难溶物不用“↓”,气体不用“↑”。 ⑦判断微溶物的处理是否正确。
微溶物做反应物时,一般用离子形式,做生成物时一般用分子式。
⑧判断反应物的滴加顺序与方程式中生成物是否一致。
如:把碳酸钠溶液滴加到盐酸溶液中,和把盐酸滴加到碳酸钠溶液中反应产物是不同的。
⑨判断反应物的相对量与产物是否一致。
有些反应因反应物的量不同会生成不同的产物。如:CO2、SO2、H2S等气体与碱溶液反应时,若气体少量,则生成正盐;若气体过量,则生成酸式盐。
⑩判断电解质在写成离子形式时阴阳离子个数比是否合理。
如Ba(OH)2溶液和稀H2SO4反应的离子方程式往往错误写成:
 ,正确为:
,正确为: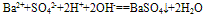
书写与量有关的离子方程式:
基本方法是:把物质的量少的物质的系数定为1,其他物质按最大量消耗。
1.因滴加顺序不同造成连续反应
- HCl与Na2CO3
向Na2CO3溶液中滴入盐酸溶液至过量,其离子反应分步写 (1)CO32-+H+==HCO3- (2)HCO3-+H+==CO2↑+H2O
若向盐酸溶液中滴入Na2CO3溶液至不再产生气体,其离子反应一步完成 CO32-+2H+==CO2↑+H2O
若向足量Na2CO3溶液中加入少量的盐酸溶液,其离子方程式为: CO32-+H+==HCO3-
- HCl与NaAlO2
向Na2CO3溶液中滴入盐酸溶液至过量,其离子反应分步写 (1)CO32-+H+==HCO3- (2)HCO3-+H+==CO2↑+H2O
若向盐酸溶液中滴入Na2CO3溶液至不再产生气体,其离子反应一步完成 CO32-+2H+==CO2↑+H2O
若向足量Na2CO3溶液中加入少量的盐酸溶液,其离子方程式为: CO32-+H+==HCO3-
- AlCl3与NaOH
向AlCl3溶液中滴入NaOH溶液至过量,其离子反应分步写 (1)Al3++3OH-==Al(OH)3↓ (2)Al(OH)3+OH-==AlO2-+2H2O
若向NaOH溶液中加入少量AlCl3溶液,其离子反应一步完成 Al3++4OH-==AlO2-+2H2O
若向足量Al2(SO4)3溶液中加入少量的NaOH溶液,其离子方程式为: Al3++3OH-==Al(OH)3↓
- AgNO3与NH3·H2O
向AgNO3溶液中滴入稀NH3·H2O至过量,其离子反应分步写(1) Ag++NH3·H2O==AgOH↓+NH4+ (2)AgOH+2NH3·H2O==Ag(NH3)2++OH-+2H2O
若向NH3·H2O溶液中加入少量AgNO3,其离子反应一步完成 Ag++3NH3·H2O==Ag(NH3)2++OH-+NH4++2H2O
若向足量AgNO3溶液中滴入少量NH3·H2O,其离子方程式为:Ag++NH3·H2O==AgOH↓+NH4+
- CO2与NaOH
向NaOH溶液中通人CO2气体至过量,其离子反应分步写 (1)2OH-+CO2==CO32-+H2O (2)CO32-+CO2+H2O==2HCO3-
若向足量NaOH溶液中通人少量CO2气体,其离子方程式为: 2OH-+CO2==CO32-+H2O
若向NaOH溶液中通人过量CO2气体,其离子反应一步完成 OH-+CO2==HCO3-
2.过量型:
向足量的Ca(HCO3)2溶液中逐渐滴入NaOH溶液 OH-+Ca2++HCO3-==H2O+CaCO3↓
向足量的NaOH溶液中逐渐滴入Ca(HCO3)2溶液 Ca2++2HCO3-+2OH-==2H2O+CaCO3↓+CO32-
Fe与HNO3 :铁过量时:Fe+4HNO3==Fe(NO3)3+NO↑+2H2O
铁不足时:3Fe+8HNO3==3Fe(NO3)2+2NO↑+4H2O
3.定量型:
因还原性I->Fe2+>Br-,所以在FeI2或者FeBr2中通入一定量的Cl2,发生不同的离子反应,依次为:
(1)2I-+Cl2==2Cl-+I2(2)2Fe2++Cl2==2Fe3++2Cl-(3)2Br-+Cl2==2Cl-+Br2
4.目标型
向明矾溶液逐滴滴加Ba(OH)2溶液至硫酸根离子刚好沉淀完全 Al3++SO42-+Ba2++4OH-==AlO2-+2BaSO4↓+2H2O
向明矾溶液逐滴滴加Ba(OH)2溶液至铝离子刚好沉淀完全 Al3+SO42-+Ba2++3OH-==Al(OH)3↓+2BaSO4↓
不管化学反应是一步完成还是分几步完成,其反应热是相同的。换句话说,化学反应的反应热只与反应的始态和终态有关,而与反应进行的途径无关。如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一一步完成时的反应热是相同的,这就是盖斯定律。
盖斯定律的意义:
利用盖斯定律可以间接计算某些不能直接测得的反应的反应热。例如:
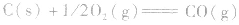 的△H无法直接测得,可以结合下面两个反应的△H,利用盖斯定律进行计算。
的△H无法直接测得,可以结合下面两个反应的△H,利用盖斯定律进行计算。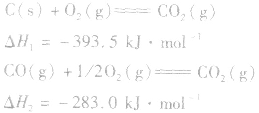
根据盖斯定律,就可以计算出所给反应的△H。分析上述两个反应的关系,即知
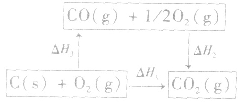
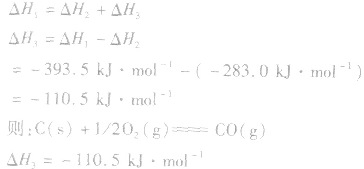
盖斯定律在反应热大小比较中的应用:
1.同一反应生成物状态不同时
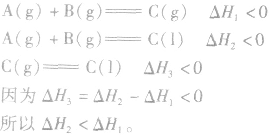
若按以下思路分析:
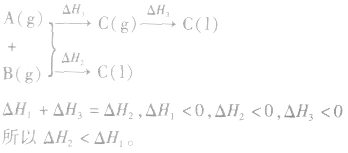
2.同一反应物状态不同时
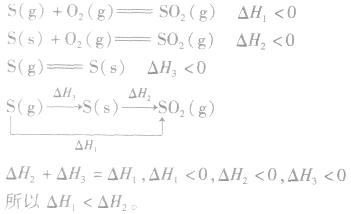
3.两个有联系的不同反应相比
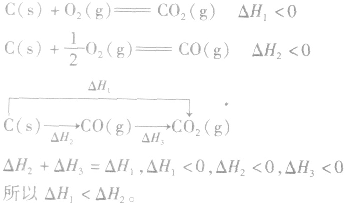
并且据此可写出下面的热化学方程式:

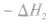
1.内因:参加反应的物质的结构及性质。
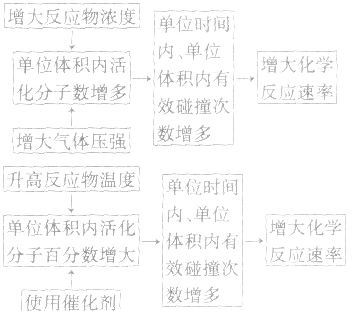
2.外因:主要是指浓度、温度、压强和催化剂,另外还有光、超声波、激光、搅拌、固体表面积、形成原电池等。
(1)浓度:其他条件相同时,增大反应物浓度,化学反应速率增大;减小反应物浓度,化学反应速率减小。在一定温度下,同体、纯液体的浓度视为定值,如C与CO2的反应、Na与H2O的反应中,C的量和Na、H2O 的量减少并不意味着其“浓度”减小,即不冈其量的增减而影响反应速率,但会因固体表面积的变化而改变反应速率。
(2)温度:其他条件相同时,升高温度,可以加快反应速率,实验测得,温度每升高10℃,化学反应速率通常增大到原来的2~4倍。
经验公式为
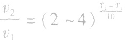
(3)压强:对于气体反应,当温度不变时,增大压强可以加快反应速率。对于气体反应体系,压强改变时有以下几种情况:

(4)催化剂:催化剂是能改变化学反应速率但在反应前后本身的质量和化学性质都不变的物质。对于某些化学反应,使用正催化剂能显著加快化学反应速率。
(5)其他因素:增大同体的表面积(如将块状改为粉末状),可增大反应速率;光照一般也可增大某些反应的速率;形成原电池可以加快反应速率;此外,超声波、放射线、电磁波等因素也能影响反应速率。
3.外因对化学反应速率影响的微观解释
1.垃圾处理
三原则:无害化 减量化 资源化
三方法:卫生填埋 堆肥 焚烧
卫生填埋:处理量最大,最终手段 浪费土地,地表水有重金属
堆肥:用微生物处理其中的有机物,成肥料,但重金属可对土地污染
焚烧:高温烧成灰渣,再填埋,可发电,占地少、减量大、但有空气污染物
2.城市生活垃圾分类标志
(1)粗分6个:可回收物、有害垃圾、大件垃圾、可堆肥垃圾、其他垃圾、可燃垃圾
(2)细分8个:织物、瓶罐、厨余垃圾、电池、纸类、塑料、金属、玻璃
3.常见垃圾造成的污染
①废旧电池:含汞作缓蚀剂
②医疗垃圾:含多种致病菌,属高危险性、高污染性废物,要焚烧,但要防产生二噁英
③白色污染:废旧塑料(占垃圾5-14%)难降解引起的污染 污染土壤、地下水,危害动物、焚烧放毒气
处理:改进配方、生产工艺
3R运动 减量化 Reduce 再利用 Reuse 再循环 Recycle
热塑性的塑料:分类、清洗、热熔;热固性的塑料:粉碎、加黏合剂成填料
再利用的关键 塑料的分类回收 热裂解法成汽油、乙烯等
与“废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧...”考查相似的试题有:
- 下表中评价合理的是选项化学反应及其离子方程式评价A铁与稀盐酸反应: 2Fe+6H+=2Fe3++3H2↑正确B大理石溶于醋酸的反应:CaCO3...
- 下列离子方程式书写正确的是 ( )A.氯化铁溶液与铁粉反应:Fe3++Fe=2Fe2+B.NO2与水的反应:3NO2+H2O=2HNO3+NOC.石灰石溶...
- 含铬化合物有毒,对人畜危害很大。因此含铬废水必须进行处理才能排放。已知:(1)在含+6价铬的废水中加入一定量的硫酸和硫...
- 能正确表示下列反应离子方程式的是( )A.铁和稀硝酸反应:Fe+2H+=Fe2++H2↑B.氢氧化钡和稀硫酸反应:H++OH-=H2OC.碳酸钙和...
- 将2.5g碳酸钠、碳酸氢钠和氢氧化钠固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol/L的盐酸,所加入盐酸的...
- 下列离子方程式书写正确的是( )A.Na2CO3溶液中通入少量CO2:CO32-+CO2+H2O=2HCO3-B.氯气通入亚硫酸钠溶液中:2Cl2+SO32-+...
- 下列离子方程正确的是( )A.氢氧化铜与稀硝酸的反应:OH-+H+=H2OB.将金属钠加入水中:Na+2H2O=Na++2OH-+H2↑C.氢氧化钡溶...
- 某温度下,在密闭容器中SO2、O2、SO3三种气态物质建立化学平衡后,改变条件对反应2SO2(g)+O2(g)2SO3(g),ΔH < 0的正、逆反应...
- 下列事实中,什么因素影响了化学反应的速率?(1)夏天的食品容易霉变,冬天就不容易发生该现象______;(2)熔化的氯酸钾放...
- 用铁片与稀盐酸反应制取氢气时,下列措施不能使氢气生成速率增大的是A.给该反应体系适当加热B.向反应体系中加水稀释C.向反...