本试题 “目前工业上有一种方法是用CO2来生产燃料甲醇.为探究其反应原理,现进行如下实验,在体积为2L的密闭容器中,充入2mol CO2和6mol H2,一定条件下发生反应:CO2...” 主要考查您对勒夏特列原理
化学反应的限度
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 勒夏特列原理
- 化学反应的限度
原理内容:
如果改变影响平衡的一个条件(如浓度、压强、温度),平衡将向着能够减弱这种改变的方向移动。勒夏特列原理又叫平衡移动原理。
适用范围:
平衡移动原理适用于化学平衡、溶解平衡、电离平衡、水解平衡等动态平衡。
注意事项:
(1)平衡向“减弱”外界条件变化的方向移动,但不能“抵消”外界条件的变化。
(2)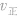 增大并不意味着平衡一定向正反应方向移动,只有
增大并不意味着平衡一定向正反应方向移动,只有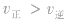 时才可以肯定平衡向正反应方向移动。
时才可以肯定平衡向正反应方向移动。
(3)当平衡向正反应方向移动时,反应物的转化率并不一定提高,生成物的体积分数也并不一定增大(因为反应物或反应混合物的总量增大了),增大一种反应物的浓度会提高另一种反应物的转化率。
(4)存在平衡且平衡发生移动时才能应用平衡移动原理。
分析思路:
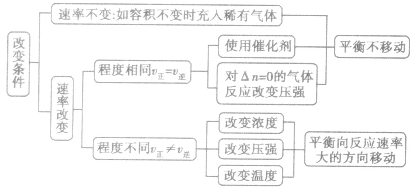
如果改变影响平衡的一个条件(如浓度、压强、温度),平衡将向着能够减弱这种改变的方向移动。勒夏特列原理又叫平衡移动原理。
适用范围:
平衡移动原理适用于化学平衡、溶解平衡、电离平衡、水解平衡等动态平衡。
注意事项:
(1)平衡向“减弱”外界条件变化的方向移动,但不能“抵消”外界条件的变化。
(2)
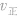 增大并不意味着平衡一定向正反应方向移动,只有
增大并不意味着平衡一定向正反应方向移动,只有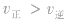 时才可以肯定平衡向正反应方向移动。
时才可以肯定平衡向正反应方向移动。 (3)当平衡向正反应方向移动时,反应物的转化率并不一定提高,生成物的体积分数也并不一定增大(因为反应物或反应混合物的总量增大了),增大一种反应物的浓度会提高另一种反应物的转化率。
(4)存在平衡且平衡发生移动时才能应用平衡移动原理。
分析思路:

化学反应的限度:
研究可逆反应所能达到的最大程度。也就是化学平衡状态。
达到反应限度的判断:
(1)v正=v逆
(2)体系中各组分的物质的量浓度或体积分数、物质的量分数保持不变。
(3)全是气体参加的、前后化学计量数改变的可逆反应,压强、平均相对分子量保持不变。
(4)对于有颜色的物质参加或生成的可逆反应,颜色不随时间发生变化
(5)对于同一物质而言,断裂化学键的物质的量与形成化学键的物质的量相等
研究可逆反应所能达到的最大程度。也就是化学平衡状态。
达到反应限度的判断:
(1)v正=v逆
(2)体系中各组分的物质的量浓度或体积分数、物质的量分数保持不变。
(3)全是气体参加的、前后化学计量数改变的可逆反应,压强、平均相对分子量保持不变。
(4)对于有颜色的物质参加或生成的可逆反应,颜色不随时间发生变化
(5)对于同一物质而言,断裂化学键的物质的量与形成化学键的物质的量相等
发现相似题
与“目前工业上有一种方法是用CO2来生产燃料甲醇.为探究其反应原...”考查相似的试题有:
- 下列事实,能用勒夏特列原理解释的是( )A.溴水中有平衡:Br2+H2O⇌HBr+HBrO 加入 AgNO3溶液后,溶液颜色变浅B.对CO(g)+N...
- 某恒容器中充入1molA和2molB发生反应:A(g)+2B(g)⇌2C(g)△H<0;下列图象能正确表达其含义的是( )A.B.C.D.
- 钾是-种活泼的金属,工业上通常用金属钠和氯化钾在高温下反应制取.该反应为:Na(l)+KCl(l)⇌NaCl(l)+K(g)△H>0各物质...
- 同时符合下列两个图象的反应是(温度T1>T2)( )A.N2O3(g)⇌NO2(g)+NO(g);△H>0B.H2(g)+I2(g)⇌2HI(g);△H>0...
- 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( ) A.反应的化学方程式为:...
- 在容积为2L的密闭容器中,进行反应:A(g)+2B(g)C(g)+D(g)在不同温度下,D的物质的量n(D)和时间t的关系如图所示.试...
- 运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义.(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2...
- 在一定温度下,4L密闭容器内存在反应2N═M,其中气体M、气体N的物质的量随时间变化的曲线如图所示:(1)比较t2时刻,正逆反应...
- 如图,甲、乙、丙分别表示在不同条件下,可逆反应A(g)+B(g)⇌xC(g)的生成物C在反应混合物中的百分含量w(C)和反应时间...
- 化学中常用图象直观地描述化学反应的进程或结果.下列图象描述正确的是( )A.根据图①可判断可逆反应“A2(g)+3B2(g)⇌2AB3...