本试题 “[化学--物质结构与性质]四种常见元素:A、B、C、D为周期表前四周期元素,原子序数依次递增,它们的性质或结构信息如下表.试根据信息回答有关问题.元素ABCD...” 主要考查您对电子排布式
原子核外电子的排布
杂化轨道理论(中心原子杂化方式)
电负性
范德华力
氢键
化学反应热的计算
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 电子排布式
- 原子核外电子的排布
- 杂化轨道理论(中心原子杂化方式)
- 电负性
- 范德华力
- 氢键
- 化学反应热的计算
电子排布式:
①简化电子排布式
为了避免电子排布式书写过于繁琐,把内层电子达到稀有气体元素原子结构的部分以相应稀有气体的冗素符号外加方括号表示,即为简化电子排布式,如K 的简化电子排布式为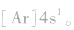
②特殊电子排布式
有个别元素的基态原子的电子排布对于构造原理有1个电子的反常。因为能量相同的原子轨道在全充满( )、半充满(
)、半充满(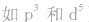 )和全空(
)和全空(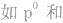
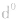 )状态时,体系的能量较低,原子较稳定。
)状态时,体系的能量较低,原子较稳定。 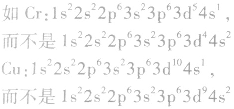
(2)电子排布图:用方框表示一个原子轨道,用箭头“↑”或“↓”来区别自旋状态不同的电子。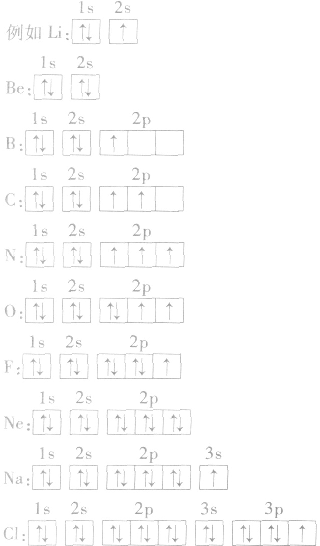
构造原理:
多电子原子的核外电子排布总是按照能量最低原理,由低能级逐步填充到高能级。绝大多数元素的原子核外电子的排布遵循下图所示的排布顺序,这种排布顺序被称为构造原理。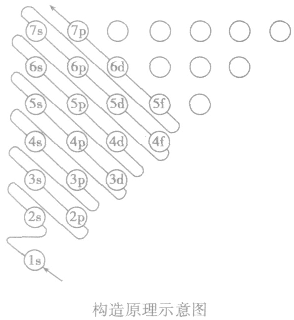
点拨:构造原理中的排布顺序,其实质是各能级的能量高低顺序,可由下列公式得出ns<(n一2)f< (n一1)d<np(n表示能层序数)。常用的重要的能级交错顺序有: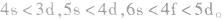
核外电子排布式一构造原理的应用:
根据构造原理,按照能级顺序,用能级符号右上角的数字表示该能级上电子数的式子,叫做电子排布式。例如,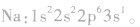
原子核外电子的排布:
在多电子原子中,由于各电子所具有的能量不同,因而分布在离核远近不同的区域内做高速运动。能量低的电子在离核近的区域内运动,能量高的电子在离核较远的区域内运动。
电子层:
电子层在含有多个电子的原子里,电子分别存能量不同的区域内运动。我们把不同的区域简化为不连续的壳层,也称作电子层,分别用n=1,2,3,4,5.6,7或K、L、 M、N、O、P、Q来表示从内到外的电子层 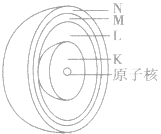

原子结构与元素的性质:
原子的核外电子排布对元素的化学性质有着非常重要的影响。元素的化学性质主要取决于原子的核外最外层电子数。
1.元素的金属性、非金属性(得失电子能力)与最外层电子数的关系
(1)稀有气体元素原子最外层电子数为8(He为 2),已达稳定结构,既不易失电子也小易得电子,所以化学性质不活泼。
(2)金属元素原子最外层电子数一般小于4,较易失去电子而达到稳定结构,其单质表现还原性。
(3)非金属元素原子最外层电子数一般大于或等于4,较易获得电子而达到稳定结构,其单质多表现氧化性。
2.元素的化合价与原子最外层电子数的关系
元素显正价还是显负价及其数值大小与原子的最外层电子数密切相关。其一般规律可归纳如下表: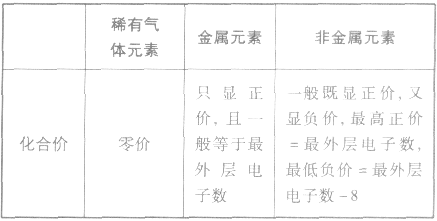
核外电子排布的一般规律:
(1)原子核外各电子层最多容纳2n2个电子.
(2)原子最外层电子数目不超过8个(K层为最外层时不超过2个)。
(3)次外层电子数目不超过18个(K层为次外层时不超过2个,L层为次外层时不超过8个)。倒数第三层电子数目不超过32个。
(4)核外电子分层排布,电子总是优先排布在能量最低的电子层里,然后由里向外,依次排布在能量逐渐升高的电子层里,即最先排K层,当K层排满后,冉排L层等。原子核外电子排布不是孤立的,而是相互联系的。层数相同而位置不同的电子层中最多容纳的电子数小一定相同,如N层为最外层时,最多只能排8个电子;N层为次外层时,最多只能排18个电子而不是32个电子(2×42=32)。
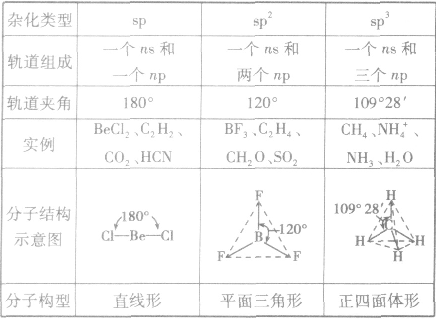
是鲍林为了解释分子的立体结构提出的。中心原子杂化轨道、孤电子对数及与之相连的原子数间的关系是:杂化轨道数=孤电子对数+与之相连的原子数。杂化前后轨道总数比变,杂化轨道用来形成σ键或容纳孤对电子,未杂化的轨道与杂化轨道所在平面垂直,可用来形成π键。
常见杂化方式:
(1)sp杂化:直线型 如:CO2、CS2
(2)sp2杂化:平面三角形(等性杂化为平面正三角形) 如:BCl3 C2H4
不等性杂化为V字型 如:H2O H2S OF2
(3)sp3杂化:空间四面体(等性杂化为正四面体) 如:CH4、CCl4
不等性杂化为三角锥 如:NH3 PCl3 H3O+
sp3d杂化:三角双锥
sp3d2杂化:八面体(等性杂化为正八面体)
分子的构型与杂化类型的关系:
电负性:
(1)键合电子、电负性的定义
元素相互化合时,原子中用于形成化学键的电子称为键合电子。电负性用来描述不同元素的原子对键合电子吸引力的大小。
(2)电负性的意义:电负性越大的原子,对键合电子的吸引力越大。
(3)电负性大小的标准:以氟的电负性为4.0作为相对标准。
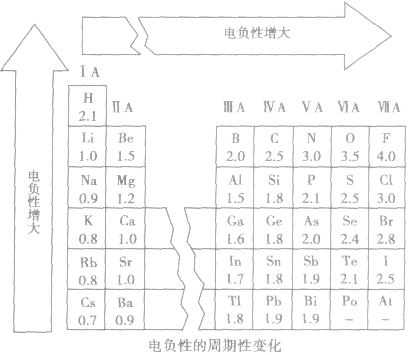
(4)电负性的变化规律
①随原子序数的递增,元素的电负性呈周期性变化。
②同周期,从左到右,元素的电负性逐渐变大。
③同主族,从上到下,元素的电负性逐渐变小。
电负性的应用:
①判断元素的金属性和非金属性的强弱
金属的电负性一般小于1.8,非金属的电负性一般大于1.8,而位于非金属三角区边界的“类金属”(如锗、锑等)的电负性则在1.8左右,它们既有金属性,又有非金属性。
②判断元素化合价的正负
利用电负性可以判断化合物中元素化合价的正负:电负性大的元素易呈现负价,电负性小的元素易呈现正价。
③判断化学键的类型
一般认为,如果成键原子所属元素的电负性差值大于 1.7,它们之间通常形成离子键;如果成键原子所属元素的电负性差值小于1.7,它们之间通常形成共价键。
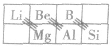
④解释“对角线规则”
在元素周期表中,某些主族元素与其右下方的主族元素(如右图所示)的有些性质是相似的,被称为“对角线规则”。例如:硼和硅的含氧酸盐都能形成玻璃且互熔,含氧酸都是弱酸等。
范德华力:
(1)概念:分子之间普遍存在的一种把分子聚集在一起的相互作用力。范德华力的作用能通常比化学键的键能小得多,一般只有2~20kJ/mol,主要影响物质的物理性质(熔、沸点和溶解度等)。
(2)规律:组成和结构相似的由分子构成的物质,相对分子质量越大,范德华力越大,物质的熔、沸点越高。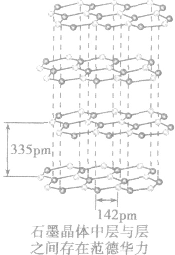
水分子间氢键的表示方法及意义:
(1)表示方法:如下图所示

(2)意义:水分子问存在氢键,使水的熔点和沸点升高,高于同主族其他元素的气态氢化物,所以常温常压下水呈液态。另外,在同态水(冰晶体)中,水分子间以氢键结合成排列规整的晶体,水分子间的氢键使冰的结构里存在较大的空隙,造成体积膨胀、密度减小至低于液态水的密度。水的这种性质对水生动物的生存有重要意义。
范德华力和氢键:
| 范德华力 | 氢键 | |
| 概念 | 把分子聚集在一起的作用力 | 分子中与氢原子形成共价键的非金属元素原子如果吸引电子的能力很强,原子半径很小,则使氢原子几乎成为“裸露”的质子,带部分正电荷,这样的分子之间氢核与带部分负电荷的非金属元素原子相互吸引,这种静电作用就是氢键 |
| 存在范围 | 分子之间 | 某些含强极性键的氢化物分子间(如 HF、H2O、NH3)等 |
| 强弱比较 | 比化学键弱得多 | 比化学键弱,但比范德华力强 |
| 影响因素 | 组成和结构相似的由分子组成的物质,相对分子质量越大,范德华力越大 | 形成氢键的除H外的非金属元素原子吸引电子的能力越强,半径越小,则氢键越强 |
| 对物质性质的影响 | 影响物质的熔沸点、溶解度等物理性质。一般来说,组成和结构相似的由分子组成的物质,随相对分子质量的增大,物质的熔沸点升高,如熔沸点: 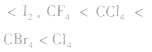 |
分子间氢键的存在,使物质的熔沸点升高,在水中的溶解度增大,如熔沸点:H2O 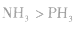 |
氢键:
(1)概念:已经与电负性很大的原子(如N、O、F) 形成共价键的氢原子与另一个电负性很大的原子(如 N、O、F)之问的作用力。如水分子问的氢键如下图所示。 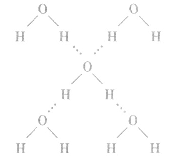
(2)表示方法:A—H…B一(A、B为N、O、F“一” 表示共价键,“…”表示形成的氢键)。
(3)分类
(4)属性:氢键不属于化学键,它属于一一种较强的分子间作用力,其作用能大小介于范德华力和化学键之间。
(5)对物质性质的影响
①氢键对物质熔、沸点的影响。分子问存在氧键时,破坏分子问的氢键,需要消耗更多的能量,所以存在氢键的物质具有较高的熔点和沸点。
例如:氮族、氧族、卤素中的N、O、F的氧化物的熔、沸点的反常现象。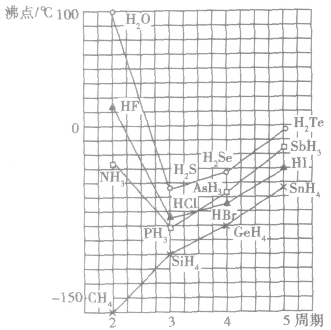
②氢键对物质溶解度的影响:氢键的存在使物质的溶解性增大。例如:NH3极易溶解于水,主要是由于氨分子和水分子之问形成了氢键,彼此互相缔合,因而加大了溶解。再如乙醇、低级醛易溶于水,也是因为它们能与水分子形成氢键。
③氢键的存在会引起密度的变化。水结冰时体积膨胀、密度减小的反常现象也可用氢键解释:在水蒸气中水以单个的水分子形式存在;在液态水中,通常是几个水分子通过氢键结合,形成(H2O)n小集团;在固态水(冰)中,水分子大范围地以氢键互相连接,成为疏松的晶体,因此在冰的结构中有许多空隙,造成体积膨胀,密度减小。
④分子内氢键与分子间氢键对物质性质的不同影响:氢键既可以存在于分子内部的原子之间,也可以存在于分子间的原子之间,只不过这两种情况对物质性质的影响程度是不一样的。例如,邻羟基苯甲醛存在分子内氢键: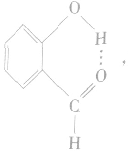 熔点为2℃,沸点为196. 5℃;对羟基苯甲醛存在分子间氢键:
熔点为2℃,沸点为196. 5℃;对羟基苯甲醛存在分子间氢键: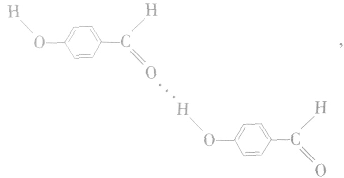 熔点为 115℃,沸点为250℃。由此可见,分子间氢键使物质的熔、沸点更高。
熔点为 115℃,沸点为250℃。由此可见,分子间氢键使物质的熔、沸点更高。
6)存在:水、醇、羧酸、酰胺、氨基酸、蛋白质、结晶水合物等物质中都能存在;生命体中许多大分子内也存在氢键,如氢键是蛋白质具有生物活性的高级结构的重要原因,DNA双螺旋的两个螺旋链也是以氢键相互结合的。
用盖斯定律结合已知反应的反应热求解一些相关反应的反应热时,其关键是设计出合理的反应过程,将已知热化学方程式进行适当数学运算得未知反应的方程式及反应热,使用盖斯定律时应注意以下问题:
(1)当反应方程式乘以或除以某数时,△H也应乘以或除以某数。
(2)反应方程式进行加减运算时,△H也同样要进行加减运算,且要带“+”“-”符号,即把△H看做一个整体进行运算
(3)通过盖斯定律计算并比较反应热的大小时,同样要把△H看做一个整体
(4)在设计的反应过程中常会遇到同一物质固、液、气三态的相互互转化,状态由固→液→气变化时。会吸热;反之会放热
(5)当设计的反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。
反应焓变(反应热)的简单计算:
1.根据热化学方程式计算焓变与参加反应的各物质的物质的量成正比。
2.根据反应物和生成物的能量计算
△H生成物的能量总和一反应物的能量总和。
3.根据反应物和生成物的键能计算
△H反应物的总键能-生成物的总踺能。
4.根据盖斯定律计算
将两个或两个以上的热化学方程式进行适当的数学运算,以求得所求反应的反应热。
5.根据比热公式进行计算
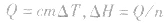
6.反应焓变的大小比较在比较两个热化学方程式中,△H的大小时要带 “+”“-”,比较反应放出或吸收的热量多少时要去掉 “+”“-” .
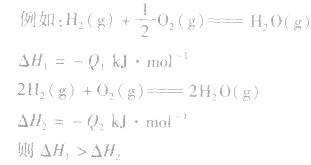
1molH2完全燃烧生成气态水时放出的热量Q1小于2molH完全燃烧生成气态水时放出的热量Q2,即
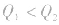 .
.与“[化学--物质结构与性质]四种常见元素:A、B、C、D为周期表前...”考查相似的试题有:
- 甲原子的L层的电子数是K层和M层电子数之和的两倍,甲元素符号为______,它的离子结构示意图为______;乙原子的-2价离子核外共...
- 按下面所要求的化学用语,表示出下列元素的原子(或离子)结构(1)铁元素原子的电子排布式:__________;(2)铬(原子序数24)...
- 下图所示为血红蛋白和肌红蛋白的活性部分--血红素的结构简式。回答下列问题:(1)血红素中含有C、H、O、N、Fe五种元素,C、N、...
- 下列说法中正确的是( )A.CO2、NH3、CCl4、N2中,所有原子都满足最外层8电子的稳定结构B.当可逆反应在一定条件下达到化学...
- (1)CaC2中C22-与O22+互为等电子体,O22+的电子式可表示为____________;O22+中键数目和键数目之为_____________________。(2)...
- 按要求填写表格。
- 钠、镁、铝是重要的金属元素,与我们的生活和生产关系密切。(1)元素的性质特别是化学性质取决于元素原子结构。钠离子的电子...
- T、X、Y、Z、Q、R、W为周期表前四周期的元素,原子序数依次递增。已知:①W的原子序数为29,其余元素均为短周期主族元素;②T原...
- 1932年,美国化学大师Linus Pauling提出电负性(用希腊字母X表示)的概念,用来确定化合物中原子某种能力的相对大小。Linus P...
- 下列说法中正确的是[ ]A.1 mol强酸与1mol强碱发生中和反应所放出的热量叫做中和热B.用渗析法可除去鸡蛋白溶液中少量的氯化...