本试题 “要从BaCl2和NaOH混合固体中获得纯净的BaCl2,设计方案如下:(1)方案一:将混合物溶于足量的水,过滤、蒸干.该方案不合理,原因是______;(2)方案二,将...” 主要考查您对过滤
离子的共存
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 过滤
- 离子的共存
过滤定义:
利用介质滤除水中杂质的方法。
通过特殊装置将流体提纯净化的过程,过滤的方式很多,使用的物系也很广泛,固-液、固-气、大颗粒、小颗粒都很常见。
在推动力或者其他外力作用下悬浮液(或含固体颗粒发热气体)中的液体(或气体)透过介质,固体颗粒及其他物质被过滤介质截留,从而使固体及其他物质与液体(或气体)分离的操作。
过滤归纳:
| 过滤的原理 | 其中一种能溶于水,另一种不能溶于水,则可以先把它们充分溶于水中,再进行过滤分离 |
| 制作过滤器 | 把一张圆形滤纸连续对折两次,得到一个四层的扇形滤纸,然后再用手捏住最外面一层滤纸展开,便得到一个一边是一层,另一边是三层的滤纸,用少量水润湿一下,把它贴在漏斗内壁上即可。 |
| 用到的仪器 | 铁架台(带铁圈)、烧杯、漏斗、玻璃棒、滤纸等 |
| 过滤装置 | 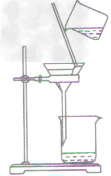 |
| 注意事项 | 操作注意事项有:一贴、二低、三靠。 一贴:滤纸紧贴漏斗内壁,以没有气泡为准,可加快过滤的速度; 二低:滤纸边缘低于漏斗边缘;漏斗内液面低于滤纸边缘,防止液体从滤纸与漏斗之间的间隙流下,使过滤不充分; 三靠:盛待过滤液体的烧杯紧靠引流的玻璃棒,防止液体溅到漏斗外丽;玻璃棒的下端紧靠在三层滤纸上,防止戳破滤纸;漏斗下端长的那侧管口紧靠烧杯内壁,防止液体溅出 |
| 过滤失败的原因 | ①滤纸破损;②过滤时液面高于滤纸边缘; ③收集滤液的烧杯不洁净 |
| 过滤操作实验口诀 | 斗架烧杯玻璃棒,滤纸漏斗角一样。 过滤之前要静置,三靠两低不要忘。 |
概念:
所谓离子共存,实质上就是看离子间是否发生反应的问题。若在溶液中发生反应,就不能共存。看能否发生反应,不仅是因为有沉淀、气体、水、难电离的物质产生,还涉及到溶液酸碱性、有色、无色,能否进行氧化还原反应等。
判断离子是否共存的方法:
复分解反应的实质就是两种化合物相互交换成分,生成两种新的化合物,所以同一溶液中的离子之间如符合下列条件之一就会发生反应,即离子不能在溶液中大量共存。
(1)生成沉淀:如Ag+和Cl-,Ba2+和SO42-,Ca2+和 CO32-,Cu2+和OH-等不能大量共存。
(2)生成气体:如H+和CO32-,HCO3-,NH4+和OH-等不能大量共存。
(3)生成水:如H+和OH-不能大量共存。
(4)可能会有附加条件,如溶液无色透明、pH=l (酸性溶液)、pH=14(碱性溶液)等。判断离子能否共存时,应先看清试题的前提条件再分析离子间的相互反应情况。
判断离子是否共存的几种情况:
①由于发生复分解反应,离子不能大量共存。
A.有气体产生。如CO32- 、SO32- 、S2- 、HCO3-、HSO3-、HS-等易挥发的弱酸的酸根与H+不能大量共存。
B.有沉淀生成。如Ba2+ 、Ca2+ 、Mg2+、Ag+等不能与SO42-、CO32-等大量共存;
Mg2+、Fe2+、Ag+、Al3+、Zn2+、Cu2+、Fe3+等不能与OH-大量共存;
Fe2+与S2-、Ca2+与PO43-、Ag+与I-不能大量共存。
C.一些酸根离子如HCO3-、HPO42-、HS-、H2PO4-、HSO3-不能与OH-大量共存;
NH4+与OH-不能大量共存。
②由于发生氧化还原反应,离子不能大量共存。
A.具有较强还原性的离子不能与具有较强氧化性的离子大量共存。
如S2-、HS-、SO32-、I-和Fe3+不能大量共存。
B.在酸性或碱性的介质中由于发生氧化还原反应而不能大量共存。
如MnO4-、NO3-、ClO-与S2-、HS-、SO32-、HSO3-、I-、Fe2+等不能大量共存;
SO32-和S2-在碱性条件下可以共存,
但在酸性条件下则由于发生2S2- +SO32- +6H+=3S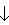 +3H2O反应不能共在。
+3H2O反应不能共在。
③溶液中能发生络合反应的离子不能大量共存。
如Fe2+ 、Fe3+与SCN-不能大量共存。
主要题目要求的限定:
①酸性溶液(H+)、碱性溶液(OH-)等不能共存的离子。
②溶液的颜色:有色离子
MnO4-(紫色)、Fe3+(棕黄)、Fe2+(浅绿)、Cu2+(蓝)等
所谓离子共存,实质上就是看离子间是否发生反应的问题。若在溶液中发生反应,就不能共存。看能否发生反应,不仅是因为有沉淀、气体、水、难电离的物质产生,还涉及到溶液酸碱性、有色、无色,能否进行氧化还原反应等。
判断离子是否共存的方法:
复分解反应的实质就是两种化合物相互交换成分,生成两种新的化合物,所以同一溶液中的离子之间如符合下列条件之一就会发生反应,即离子不能在溶液中大量共存。
(1)生成沉淀:如Ag+和Cl-,Ba2+和SO42-,Ca2+和 CO32-,Cu2+和OH-等不能大量共存。
(2)生成气体:如H+和CO32-,HCO3-,NH4+和OH-等不能大量共存。
(3)生成水:如H+和OH-不能大量共存。
(4)可能会有附加条件,如溶液无色透明、pH=l (酸性溶液)、pH=14(碱性溶液)等。判断离子能否共存时,应先看清试题的前提条件再分析离子间的相互反应情况。
判断离子是否共存的几种情况:
①由于发生复分解反应,离子不能大量共存。
A.有气体产生。如CO32- 、SO32- 、S2- 、HCO3-、HSO3-、HS-等易挥发的弱酸的酸根与H+不能大量共存。
B.有沉淀生成。如Ba2+ 、Ca2+ 、Mg2+、Ag+等不能与SO42-、CO32-等大量共存;
Mg2+、Fe2+、Ag+、Al3+、Zn2+、Cu2+、Fe3+等不能与OH-大量共存;
Fe2+与S2-、Ca2+与PO43-、Ag+与I-不能大量共存。
C.一些酸根离子如HCO3-、HPO42-、HS-、H2PO4-、HSO3-不能与OH-大量共存;
NH4+与OH-不能大量共存。
②由于发生氧化还原反应,离子不能大量共存。
A.具有较强还原性的离子不能与具有较强氧化性的离子大量共存。
如S2-、HS-、SO32-、I-和Fe3+不能大量共存。
B.在酸性或碱性的介质中由于发生氧化还原反应而不能大量共存。
如MnO4-、NO3-、ClO-与S2-、HS-、SO32-、HSO3-、I-、Fe2+等不能大量共存;
SO32-和S2-在碱性条件下可以共存,
但在酸性条件下则由于发生2S2- +SO32- +6H+=3S
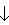 +3H2O反应不能共在。
+3H2O反应不能共在。③溶液中能发生络合反应的离子不能大量共存。
如Fe2+ 、Fe3+与SCN-不能大量共存。
主要题目要求的限定:
①酸性溶液(H+)、碱性溶液(OH-)等不能共存的离子。
②溶液的颜色:有色离子
MnO4-(紫色)、Fe3+(棕黄)、Fe2+(浅绿)、Cu2+(蓝)等
发现相似题
与“要从BaCl2和NaOH混合固体中获得纯净的BaCl2,设计方案如下:...”考查相似的试题有:
- 然后对取回的水样进行过滤,过滤需要用到的仪器是( )A.酒精灯B.托盘天平C.量筒D.漏斗
- 下图所示实验操作正确的是______
- 分离氯化铁、氯化钠、硫酸钡的固体混合物,得到三种纯净物,应选用的一组试剂是( )A.水、硝酸银、稀硝酸B.水、氢氧化钠、...
- 镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取.主要步骤如下:(1)为了使MgCl2转化为Mg(OH)2,试剂①可以选...
- 目前部分农村的饮用水主要还是地下水,饮用遭到污染或硬度大的地下水不利于人体健康.政府积极建设自来水厂,让农民喝上清洁...
- 下列说法正确的是( )A.氢氧化钠露置在空气中不易变质B.在高温下,木炭能与氧化铜发生反应,说明氧化铜具有还原性C.铁桶...
- 以下说法中正确的是( )A.复分解反应的生成物中一定有沉淀B.置换反应中一定会发生元素化合价的改变C.把 CuSO4、HNO3、BaC...
- 下列离子能在pH=2的水溶液中大量共存的是( )A.Ag+ Na+ Cl- N03-B.Na+ K+ OH- S042-C.Ba2+ Mg2+ N03- Cl-D.K+ Na+ C032-...
- 下列各组物质在某pH=14的无色溶液中,能大量共存的是( )A.FeCl3、NaCl、KNO3B.NaCl、NaOH、NaNO3C.CaCl2、NaNO3、Na2CO3...
- 下列物质能在pH=1的溶液中大量共存,且为无色透明溶液的是( )A.KOH、NaNO3、Na2CO3B.FeCl3、CaCl2、Mg(NO3)2C.KNO3、K...