本试题 “某兴趣小组用石灰石和盐酸反应制取C02,并验证cOz的性质.在确认装置气密性良好后进行实验.把制得的气体通入澄清石灰水中,发现石灰水没有变浑浊.对此展开...” 主要考查您对二氧化碳的制取和收集
二氧化碳的性质
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 二氧化碳的制取和收集
- 二氧化碳的性质
二氧化碳的制取和收集:
1.原理和药品:CaCO3 + 2HCl === CaCl2 + H2O + CO2↑
2.装置:固液混合不加热
(1)发生装置
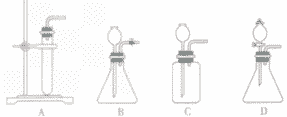
A装置为简易装置,不便于加液体;
B,C使用了长颈漏斗,便于添加液体,使用B、C装置时应注意,长颈漏斗下端管日应伸入液面以下,防止产生的气体从长颈漏斗逸出;
D装置使用了分液漏斗,便于加酸,还可以利用活塞控制反应。
(2)收集装置:二氧化碳溶于水,所以不能用排水法收集;其密度比空气大,所以可采用向上排空气法收集。
如图:
3.现象:块状固体不断溶解,产生大量气泡。
4.检验:把产生的气体通入澄清石灰水,若澄清石灰水变浑浊,证明是二氧化碳。
5.验满:将燃着的木条放在集气瓶口,如果木条的火焰熄灭,证明已集满。
6.实验步骤
a.检查装置的气密性;
b.装入石灰石(或大理石);
c. 塞紧双孔塞;
d.从长颈漏斗中加入稀盐酸;
e.收集气体;
f.验满。
7.注意事项:反应物不能用浓盐酸、硫酸、因为浓盐酸易挥发,会挥发出氯化氢气体,使制得的二氧化碳不纯;硫酸不会挥发,但会生成硫酸钙沉淀,沉淀的硫酸根附着在碳酸钙(或石灰石)表面,使碳酸钙(或石灰石)与酸的接触面积变小,最后反应停止!
实验室制取二氧化碳的选择:
实验室用大理石或石灰石(主要成分是碳酸钙)和稀盐酸制取二氧化碳。
注意:
(1)不能选用稀硫酸,因为稀硫酸与碳酸钙反应生成微溶于水的硫酸钙会橙盖在碳酸钙的表面,阻止反应继续进行。
(2)不能选用浓盐酸,因为浓盐酸易挥发,得不到纯净的二氧化碳气体。
(3)不能用碳酸钠代替石灰石,因为反应太剧烈,产生的气体难以收集。反应速率的快慢与反应物的质量分数和接触面积有关。反应物的接触面积越大,反应物的质量分数越大,反应速率就越快,反之,则越慢。
各组物质反应情况如下表所示:
| 药品 | 反应速率 |
| 块状石灰石和稀盐酸 | 产生气泡速率适中 |
| 石灰石粉末和稀盐酸 | 产生气泡速率很快 |
| 块状石灰石和稀硫酸 | 产生气泡速率缓慢并逐渐停止 |
| 碳酸钠粉末和稀盐酸 | 产生气泡速率很快 |
二氧化碳是空气中常见的化合物,其分子式为CO?,由两个氧原子与一个碳原子通过共价键连接而成,常温下是一种无色无味气体,密度比空气略大,能溶于水,与水反应生成碳酸。固态二氧化碳俗称干冰。二氧化碳被认为是造成温室效应的主要来源。
物理性质:
常温下,二氧化碳是一种无色无味的气体,密度比空气大,能溶于水。
固态的二氧化碳叫做干冰。
化学性质:
(1)一般情况下,二氧化碳不能燃烧,也不支持燃烧,不供给呼吸,因此当我们进入
干枯的深井,深洞或久未开启的菜窖时,应先做一个灯火实验,以防止二氧化碳浓度
过高而造成危险
(2)二氧化碳和水反应生成碳酸,使紫色石蕊试液变红:CO2 + H2O===H2CO3,
碳酸不稳定,很容易分解成水和二氧化碳,所以红色石蕊试液又变回紫色:
H2CO3===H2O + CO2↑
(3)二氧化碳和石灰水反应:Ca(OH)2 + CO2====CaCO3↓+ H2O
(4)二氧化碳可促进植物的光合作用:6CO2+6H2O
 C6H12O6+6O2
C6H12O6+6O2 一氧化碳和二氧化碳性质的比较:
|
|
|
一氧化碳 |
二氧化碳 |
|
物理性质 |
状态 |
无色,无味气体 |
无色,无味气体 |
|
密度 |
1.250g/l(略小于空气) |
1.977g/l(大于空气) | |
|
溶解性 |
1体积水中约溶解0.02体积 |
1体积中约溶解1体积 | |
|
化学性质 |
可燃性 |
有可燃性 |
一般情况下,既不能燃烧,也不能支持燃烧 |
|
还原性 |
有还原性: |
没有还原性 | |
|
跟水反应 |
不能 |
能:CO2+H2O==H2CO3 | |
|
跟澄清石灰水反应 |
不能 |
CO2+Ca(OH)2==CaCO3↓+H2O | |
|
毒性 |
有毒 |
无毒 | |
|
主要用途 |
作气体燃料,用于高炉炼铁 |
灭火,人工降雨,干冰制冷剂等,作化工原料和温室肥料 | |
|
相互转化 |
C+O2 CO2 CO2C+CO2  2CO 2CO | ||
干冰:
一定条件下,二氧化碳气体会变成固体,固体二氧化碳叫“干冰”。干冰升华时,吸收大量的热,因此可作制冷剂。如果用飞机向云层中撤干冰,由于干冰升华吸热,空气中的水蒸气迅速冷凝变成水滴,就可以形成降雨。
二氧化碳不一定能灭火:
二氧化碳一般不支持燃烧,但在一定条件下,某些物质也可以在二氧化碳中燃烧,如将点燃的镁条伸入盛有二氧化碳的集气瓶中,镁条能继续燃烧,反应的化学方程式为:2Mg+CO2
 2MgO+C,所以活泼金属着火不能用二氧化碳来灭火
2MgO+C,所以活泼金属着火不能用二氧化碳来灭火 二氧化碳与一氧化碳的鉴别方法:
(1)澄清石灰水:将气体分别通入澄清石灰水中,能使澄清石灰水变浑浊的是二氧化碳,无明显现象的是一氧化碳。
(2)燃着的木条:将气体分别在空气中点燃,能燃烧的是一氧化碳,不能燃烧的是二氧化碳。
(3)紫色石蕊试液:将气体分别通入紫色石蕊试液中,能使石蕊试液变红的是二氧化碳,无明显现象的是一氧化碳。
(4)还原金属氧化物:将气体分别通过灼热的氧化铜,出现黑色粉末变红这一现象的是一氧化碳,没有明显现象的是二氧化碳。
二氧化碳与一氧化碳的除杂方法:
1.CO(CO2)(括号内的物质为杂质):通常将气体通人过量的碱溶液(一般用氢氧化钠溶液而不用澄清石灰水)中,二氧化碳与碱溶液反应,从而达到除杂的目的。
2.CO2(CO)(括号内的物质为杂质):通常将气体通过灼热的氧化铜,一氧化碳与氧化铜反应生成铜和二氧化碳,从而达到除杂的目的。不能用点燃的方法,因为CO2不支持燃烧,也不能燃烧。
二氧化碳与石灰石的应用:
二氧化碳与石灰水反应出现白色沉淀,反应的方程式为:CO2+Ca(OH)2==CaCO3↓+H2O。
该反应及现象有以下儿方面的应用:
(1)检验二氧化碳气体;
(2)鉴别NaOH溶液和澄清石灰水:将CO2气体通入待测溶液中,生成白色沉淀的溶液为澄清石灰水,无明显现象的为NaOH溶液;
(3)除去某些气体中的杂质:如除去CO中的CO2 气体,可将混合气体通过澄清石灰水;
(4)解释澄清石灰水为什么要密封保存:敞口放置的澄清石灰水会吸收空气中的CO2而使澄清石灰水表面生成一层白膜或变浑浊,其成分是CaCO3;
(5)用石灰砂浆砌砖抹墙不久后变白变硬:石灰砂浆的主要成分是Ca(OH)2,吸收空气中的CO2发生反应Ca(OH)2声称白色固体CaCO3固体。
(6)保存鸡蛋:将鸡蛋浸泡在澄清石灰水中,取出来后CO2与石灰水反应封闭鸡蛋壳上的小孔,可以延长鸡蛋的保存时间。
二氧化碳肥料:
二氧化碳是光合作用的原料之一,因而现在在温室大棚内种植蔬菜水果时,经常人为提高温室内CO2 浓度,以增加农作物产员,增大CO2浓度的方法通常有以下几种:
(1)在温室内放置干冰,干冰升华增大CO2浓度。
(2)在温室内放置通过化学反应产生CO2气体的物质,如在塑料大棚顶部的容器内放置石灰石和稀盐酸。
灯火实验:
(1)二氧化碳本身无毒,但它不供给呼吸,当空气中二氧化碳含量超过常量时,也会对人体健康产生不良影响。
| 空气中二氧化碳的体积分数/% | 对人体健康的影响 |
| 1 | 感到气闷,头昏,心悸 |
| 4—5 | 气喘,头痛,眩晕 |
| 10 | 神志不清,呼吸停止,死亡 |
与“某兴趣小组用石灰石和盐酸反应制取C02,并验证cOz的性质.在...”考查相似的试题有:
- 现有下列仪器:①锥形瓶;②酒精灯;③长颈漏斗;④石棉网;⑤导气管;⑥水槽;⑦集气瓶.其中在制取和收集二氧化碳时肯定用不上的是...
- (7分)实验室制取氧气是同学们必须掌握的实验技能。请回答:(1)E操作名称叫 ;(2)小欣用上图BC装置制取氧气。检查装置气...
- 请结合如图中实验室常用装置,回答有关问题:(1)写出图A中反应容器的名称______.(2)若用高锰酸钾制取氧气,应选用的发生...
- 某化学实验小组的同学用如下图所示装置进行制备气体的探究。(1)实验室制取二氧化碳的化学方程式为 。为了检验是否有二氧化...
- 下列气体能用集气瓶开口向下法收集的是( )A.N2B.O2C.H2D.CO2
- 某校九(5)班学生进行一系列的实验,请结合下图帮助他们解决以下问题:A B C D E F(1)写出图中有标号仪器的名称:① ,② 。...
- 二氧化碳下列用途,只与它的物理性质有关的是( )A.灭火B.制化肥C.制干冰D.温室肥料
- 下列有关“不一定”的说法正确的是[ ]①化合物中的某种元素转变为单质,不一定要通过分解反应②在一定的条件下二氧化碳与水反应不...
- (1)空气中的二氧化碳超过正常含量时,会对人体健康产生如下影响:(2)空气中二氧化碳的含量与蜡烛是否燃烧及澄清石灰水是...
- 氢氧化钠在工业生产中有广泛的用途.下列有关氢氧化钠的叙述,不正确的是( )A.氢氧化钠易潮解,可作某些气体的干燥剂B.称...
 2CO2
2CO2 Cu+CO2
Cu+CO2