本试题 “下列说法正确的是[ ]A、厨房洗涤剂具有溶解油污的作用B、食盐溶于水制成的冰袋可用于给高烧病人降温C、冰投入水中,冰是溶质,水是溶剂D、在抗击雪灾中,向公...” 主要考查您对溶解
乳化和乳化作用
溶液的定义、组成及特征
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 溶解
- 乳化和乳化作用
- 溶液的定义、组成及特征
溶解定义:
广义上说,超过两种以上物质混合而成为一个分子状态的均匀相的过程称为溶解。而狭义的溶解指的是一种液体对于固体/液体/或气体产生化学反应使其成为分子状态的均匀相的过程称为溶解。一种物质(溶质)分散于另一种物质(溶剂)中成为溶液的过程。如食盐或蔗糖溶解于水而成水溶液。溶液并不一定为液体,可以是固体、液体、气体。比如均匀的合金和空气都可以称为溶液。当两种物质互溶时,一般把质量大的物质称为溶剂(如有水在其中,一般习惯将水称为溶剂)。
溶解过程:
物质溶解于水,通常经过两个过程:一种是溶质分子(或离子)的扩散过程,这种过程为物理过程,需要吸收热量;另一种是溶质分子(或离子)和溶剂(水)分子作用,形成溶剂(水合)分子(或水合离子)的过程,这种过程是化学过程,放出热量。当放出的热量大于吸收的热量时,溶液温度就会升高,如浓硫酸、氢氧化钠等;当放出的热量小于吸收的热量时,溶液温度就会降低,如硝酸铵等;当放出的热量等于吸收的热量时,溶液温度不变,如盐、蔗糖。
固体、液体及气体溶解的对比分析:
(1)固体溶解
固体溶解时,常需要粉碎,加热,震荡,搅拌等方法加速溶解。

(2)液体溶解
一般液体溶解时,将液体加水搅拌均匀。
(3)气体溶解
气体溶解时,对于溶解度小的气体要把导管插入水中,极易溶于水的气体,应在导管末端插一倒置的漏斗,漏斗边缘接触水。
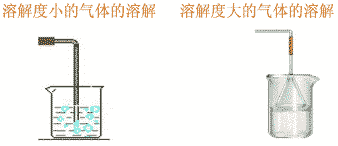
溶解性应用:
1、是指物质在溶剂里溶解能力的大小。
2、溶解性是物理性质,溶解是物理变化。
3、溶解性是由20℃时某物质的溶解度决定的。(固体)
4、利用溶解性可有以下应用:
(1)判断气体收集方法
可溶(易溶)于水的气体不能用排水取气法。
如:CO2而H2,O2溶解性不好,可用排水取气法。
(2)判断混合物分离方法
两种物质在水中溶解性明显不同时,可用过滤法分离。
如:KNO3(易溶)与CaCO3(难溶)可用过滤法分离
而C与MnO2二者均不溶NaClKNO3均易溶,都不能用过滤法分离。
溶解度算法=溶质质量/溶剂质量(通常为水)
单位: g/100g水。
广义上说,超过两种以上物质混合而成为一个分子状态的均匀相的过程称为溶解。而狭义的溶解指的是一种液体对于固体/液体/或气体产生化学反应使其成为分子状态的均匀相的过程称为溶解。一种物质(溶质)分散于另一种物质(溶剂)中成为溶液的过程。如食盐或蔗糖溶解于水而成水溶液。溶液并不一定为液体,可以是固体、液体、气体。比如均匀的合金和空气都可以称为溶液。当两种物质互溶时,一般把质量大的物质称为溶剂(如有水在其中,一般习惯将水称为溶剂)。
溶解过程:
物质溶解于水,通常经过两个过程:一种是溶质分子(或离子)的扩散过程,这种过程为物理过程,需要吸收热量;另一种是溶质分子(或离子)和溶剂(水)分子作用,形成溶剂(水合)分子(或水合离子)的过程,这种过程是化学过程,放出热量。当放出的热量大于吸收的热量时,溶液温度就会升高,如浓硫酸、氢氧化钠等;当放出的热量小于吸收的热量时,溶液温度就会降低,如硝酸铵等;当放出的热量等于吸收的热量时,溶液温度不变,如盐、蔗糖。
固体、液体及气体溶解的对比分析:
(1)固体溶解
固体溶解时,常需要粉碎,加热,震荡,搅拌等方法加速溶解。

(2)液体溶解
一般液体溶解时,将液体加水搅拌均匀。

(3)气体溶解
气体溶解时,对于溶解度小的气体要把导管插入水中,极易溶于水的气体,应在导管末端插一倒置的漏斗,漏斗边缘接触水。

溶解性应用:
1、是指物质在溶剂里溶解能力的大小。
2、溶解性是物理性质,溶解是物理变化。
3、溶解性是由20℃时某物质的溶解度决定的。(固体)
| (20℃) | 难溶(不溶) | 微溶 | 可溶 | 易溶 |
| <0.01g | 0.01g~1g | 1 g~10g | >10g |
4、利用溶解性可有以下应用:
(1)判断气体收集方法
可溶(易溶)于水的气体不能用排水取气法。
如:CO2而H2,O2溶解性不好,可用排水取气法。
(2)判断混合物分离方法
两种物质在水中溶解性明显不同时,可用过滤法分离。
如:KNO3(易溶)与CaCO3(难溶)可用过滤法分离
而C与MnO2二者均不溶NaClKNO3均易溶,都不能用过滤法分离。
溶解度算法=溶质质量/溶剂质量(通常为水)
单位: g/100g水。
乳化和乳化作用的概念:
1. 乳化现象:
乳浊液不稳定,静置分层,在乳浊液中加人洗涤剂以后,油虽然并没有溶解在水中,但这时形成的乳浊液却能均匀、稳定地存在而不分层,这种现象叫乳化现象。
“乳化”形成的并不是溶液,例如植物油中加入水,加入乳化剂并不是水溶解了油,只是使植物油分散成无数细小的液滴存在于水中而不聚集。
2. 乳浊液:小液滴分散到液体里形成的混合物。
3. 乳化作用:
乳蚀液的稳定剂是一类表面活性剂,阻止小液滴相互凝结。洗涤剂能把植物油分散成无数细小的液滴而不聚集成大的油珠,洗涤剂所起的作用就是乳化作用,使植物油分散成无数细小的液滴存在于水中而不聚集。
用汽油去油污与用洗涤剂洗去油污的不同:
利用汽油和洗涤剂均能除一去油污,但二者除去油污的原理不同。汽油溶解油污时形成溶液,但加了洗涤剂的水清洗油污是把油污分散成细小的液滴,使其形成乳浊液,再随着水漂走。
除去织物上污渍的方法:
乳化作用在生活中的应用:
①洗涤:用乳化剂(洗涤剂)可以将衣服上、餐具上的油污洗掉,如肥皂、洗洁精等。
②农药的使用:在农药中加入一定量的乳化剂后. 再溶解在有机溶剂里,混合均匀制成的透明液体叫乳油。
1. 乳化现象:
乳浊液不稳定,静置分层,在乳浊液中加人洗涤剂以后,油虽然并没有溶解在水中,但这时形成的乳浊液却能均匀、稳定地存在而不分层,这种现象叫乳化现象。
“乳化”形成的并不是溶液,例如植物油中加入水,加入乳化剂并不是水溶解了油,只是使植物油分散成无数细小的液滴存在于水中而不聚集。
2. 乳浊液:小液滴分散到液体里形成的混合物。
3. 乳化作用:
乳蚀液的稳定剂是一类表面活性剂,阻止小液滴相互凝结。洗涤剂能把植物油分散成无数细小的液滴而不聚集成大的油珠,洗涤剂所起的作用就是乳化作用,使植物油分散成无数细小的液滴存在于水中而不聚集。
用汽油去油污与用洗涤剂洗去油污的不同:
利用汽油和洗涤剂均能除一去油污,但二者除去油污的原理不同。汽油溶解油污时形成溶液,但加了洗涤剂的水清洗油污是把油污分散成细小的液滴,使其形成乳浊液,再随着水漂走。
除去织物上污渍的方法:
| 污渍 | 清洗方法 |
| 蓝墨水 | 白色织物上,可用草酸低稀溶液和漂白剂溶液轮流擦拭,再用洗涤剂和水洗;有色织物上,小心用高锰酸钾溶液擦拭,污渍去掉后,迅速用过氧化氢稀溶液擦拭污渍处,并立即用水漂洗 |
| 圆珠笔油 | 用酒精擦拭,再用洗涤剂洗,最后用水洗 |
| 菜汤,乳汁 | 用酒精擦拭,然后用稀氨水揉搓,再用水洗 |
| 水果渍 | 用氯化钠溶液洗,或用草酸稀溶液沾湿,再用水洗;如果是白色织物,可用过氧化氢稀溶液沾湿,再用水洗 |
| 血渍 | 刚沾上时,立即用冷水洗,再用洗涤剂洗,最后用水洗;沾污时间较长的,可用氨水擦拭,片刻后用冷水洗,如不能除净,用草酸稀溶液洗涤,然后用水洗 |
| 铁锈 | 草酸稀溶液清洗,然后用水洗 |
| 沥青 | 用酒精或汽油擦拭多次,然后用水洗 |
乳化作用在生活中的应用:
①洗涤:用乳化剂(洗涤剂)可以将衣服上、餐具上的油污洗掉,如肥皂、洗洁精等。
②农药的使用:在农药中加入一定量的乳化剂后. 再溶解在有机溶剂里,混合均匀制成的透明液体叫乳油。
溶液的概念:
一种或几种物质分散到另一种物质中,形成均一的,稳定的混合物,叫做溶液
溶液的组成:
(1)溶液由溶剂和溶质组成溶质:被溶解的物质溶剂:
溶液质量=溶剂质量+溶质质量
溶液的体积≠溶质的体积+溶剂的体积
(2)溶质可以是固体(氯化钠、硝酸钾等)、液体(酒精、硫酸等)或气体(氯化氢、二氧化碳等),一种溶液中的溶质可以是一种或多种物质。水是最常用的溶剂,汽油、洒精等也可以作为溶剂,如汽油能够溶解油脂,洒精能够溶解碘等。
溶液的特征:
均一性:溶液中各部分的性质都一样;
稳定性:外界条件不变时,溶液长时间放置不会分层,也不会析出固体溶质
对溶液概念的理解:
溶液是一种或儿种物质分散到另一种物质里.形成的均一、稳定的混合物。应从以下几个方面理解:
(1)溶液属于混合物;
(2)溶液的特征是均一、稳定;
(3)溶液中的溶质可以同时有多种;
(4)溶液并不一定都是无色的,如CuSO4溶液为蓝色;
(5)均一、稳定的液体并不一定郡是溶液,如水;
(6)溶液不一定都是液态的,如空气。
溶液与液体
(1)溶液并不仅局限于液态,只要是分散质高度分散(以单个分子、原子或离子状态存在)的体系均称为溶液。如锡、铅的合金焊锡,有色玻璃等称为固态溶液。气态的混合物可称为气态溶液,如空气。我们通常指的溶液是最熟悉的液态溶液,如糖水、盐水等。
(2)液体是指物质的形态之一。如通常状况下水是液体,液体不一定是溶液。
3. 溶液中溶质、溶剂的判断
(1)根据名称。溶液的名称一般为溶质的名称后加溶剂,即溶质在前,溶剂在后。如食盐水中食盐是溶质,水是溶剂,碘酒中碘是溶质,酒精是溶剂。
(2)若是固体或气体与液体相互溶解成为溶液。一般习惯将固体或气体看作溶质,液体看作溶剂。
(3)若是由两种液体组成的溶液,一般习惯上把量最多的看作溶剂,量少的看作溶质。
(4)其他物质溶解于水形成溶液时。无论,水量的多少,水都是溶剂。
(5)一般水溶液中不指明溶剂,如硫酸铜溶液,就是硫酸铜的水溶液,蔗糖溶液就是蔗糖的水溶液,所以未指明溶剂的一般为水。
(6)物质在溶解时发生了化学变化,那么在形成的溶液中,溶质是反应后分散在溶液中的生成物。如 Na2O,SO3分别溶于水后发生化学反应,生成物是 NaOH和H2SO4,因此溶质是NaOH和H2SO4,而不是 Na2O和SO3;将足量锌粒溶于稀硫酸中所得到的溶液中,溶质是硫酸锌(ZnSO4),若将蓝矾(CuSO4·5H2O) 溶于水,溶质是硫酸铜(CuSO4),而不是蓝矾。
溶液的导电性:
探究溶液导电性的实验:
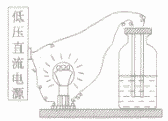
用如图所示的装置试验一些物质的导电性。可以养到蒸馏水、乙醉不导电,而盆酸、硫酸、氢氧化钠溶液、氢氧化钙溶液、氯化钠溶液、碳酸钠溶液均能导电。
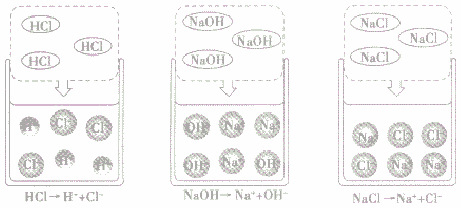
酸、碱、盐溶液导电的原因:
酸、碱、盐溶于水,在水分子作用下,电离成自由移动的带正(或负)电的阳(或阴)离子(如下图所示)。因此酸、碱、盐的水溶液都能导电,导电的原因是溶液中存在自由移动的离子,而蒸馏水和乙醇中不存在自由移动的离子。
发现相似题
与“下列说法正确的是[ ]A、厨房洗涤剂具有溶解油污的作用B、食盐...”考查相似的试题有:
- 请从B项中选择与A项中说法相关的序号填在A项后相应的括号内.A:(1)高锰酸钾难溶于汽油,易溶于水.______;(2)碘难溶于...
- 家庭厨房是一个化学世界,“柴米油盐酱醋糖”等都是化学物质,以下是探讨化学物质与生活有关的几个问题,请问:(1)现在许多地...
- 下列有关工农业生产的几个事例中,肯定与乳化现象无关的是( )A.清洗金属表面的油污B.配制化妆品C.用洗涤剂洗餐具D.配制...
- 下列常见物质不能形成溶液的是A.菜籽油B.食盐C.乙醇D.蔗糖
- 洗涤剂中的各种表面活性剂有一个共同的特点,即它们的分子中都有一个______基和一个______基.
- 从1升20%的硫酸锌溶液中取出100毫升,则余下的硫酸锌溶液的质量分数为( )A.90%B.98.8%C.20%D.10%
- 某电中性溶液中含有K+、Fe3+、SO42﹣、Cl﹣四种离子,其中K+、Fe3+、Cl﹣三种离子的个数比是5:2:3.则溶液中Fe3+与SO42﹣离...
- 糖水、生理盐水、碘酒都是我们常接触的物质,它们在组成特征上的共同点有:(1)都是混合物;(2)都是均一的、稳定的溶液;...
- 下列物质放入水中,能形成溶液的是A.牛奶B.面粉C.蔗糖D.花生油
- 生活中的下列物质放入水中能形成溶液的是[ ]A.食盐B.面粉C. 植物油D.牛奶