本试题 “下列叙述中,正确的是( )A.物质跟氧发生的反应,一定是氧化反应B.均一、稳定的液体-定是溶液C.能电离出H+的化合物一定是酸D.置换反应一定要在溶液中进行” 主要考查您对氧化反应
置换反应
溶液的定义、组成及特征
酸、碱、盐
氧化物
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 氧化反应
- 置换反应
- 溶液的定义、组成及特征
- 酸、碱、盐
- 氧化物
定义:
氧化反应:物质与氧发生的化学反应,如S+O2 SO2;H2+CuO
SO2;H2+CuO H2O+Cu.
H2O+Cu.
氧化反应与缓慢氧化:
氧化反应:物质与氧发生的化学反应,如S+O2
 SO2;H2+CuO
SO2;H2+CuO H2O+Cu.
H2O+Cu.氧化反应与缓慢氧化:
| 氧化反应 | 缓慢氧化 | |
| 概念 | 物质与氧(包括氧气)发生的化学反应 | 物质与氧气发生的缓慢的,不易察觉的氧化反应 |
| 举例 | 所有与氧气发生的反应 | 铁生锈,食物腐烂 |
| 联系 | 氧化反应包括剧烈氧化和缓慢氧化两种 | |
| 相同点 | ①都是氧化反应②都放出热量 | |
概念:由一种单质和一种化合物反应,生成另一种单质和另一种化合物的反应。
特征:单质+化合物→新单质+新化合物
表达式:A+BC=B+AC
置换反应的规律和发生条件:
特征:单质+化合物→新单质+新化合物
表达式:A+BC=B+AC
置换反应的规律和发生条件:
| 规律 | 发生条件 | 实例 |
| H2+金属氧化物→金属+水 | ①加热 ②K、Ca、Na、Mg、Al等的氧化物除外 |
H2+CuO Cu+H2O Cu+H2O3H2+Fe2O3  2Fe+3H2O 2Fe+3H2O |
| 碳+金属氧化物→金属+CO2 | ①高温 ②K、Ca、Na、Mg、Al等的氧化物除外 |
C+2CuO 2Cu+CO2↑ 2Cu+CO2↑3C+2Fe2O3  4Fe+3CO2↑ 4Fe+3CO2↑ |
| 金属+酸→盐+氢气 | ①浓硫酸,硝酸具有氧化性,和金属反应不生成氢气; ②在金属活动性顺序中排在氢前面的金属才能置换出酸中的氢 |
Zn+2HCl==ZnCl2+H2↑ Zn+H2SO4(稀)==ZnSO4+H2↑ 2Al+3H2SO4(稀)==Al2(SO4)3+3H2↑ |
| 金属+盐→新盐+新金属 | ①盐必须能溶于水 ②在金属活动性顺序表中,排在前面的金属才能置换出后面的金属 ③钾、钙、钠很活泼,与盐溶液反应不能置换出金属 |
Cu+Hg(NO3)2==Hg+Cu(NO3)2 Fe+CuSO4=FeSO4+Cu |
溶液的概念:
一种或几种物质分散到另一种物质中,形成均一的,稳定的混合物,叫做溶液
溶液的组成:
(1)溶液由溶剂和溶质组成溶质:被溶解的物质溶剂:
溶液质量=溶剂质量+溶质质量
溶液的体积≠溶质的体积+溶剂的体积
(2)溶质可以是固体(氯化钠、硝酸钾等)、液体(酒精、硫酸等)或气体(氯化氢、二氧化碳等),一种溶液中的溶质可以是一种或多种物质。水是最常用的溶剂,汽油、洒精等也可以作为溶剂,如汽油能够溶解油脂,洒精能够溶解碘等。
溶液的特征:
均一性:溶液中各部分的性质都一样;
稳定性:外界条件不变时,溶液长时间放置不会分层,也不会析出固体溶质
对溶液概念的理解:
溶液是一种或儿种物质分散到另一种物质里.形成的均一、稳定的混合物。应从以下几个方面理解:
(1)溶液属于混合物;
(2)溶液的特征是均一、稳定;
(3)溶液中的溶质可以同时有多种;
(4)溶液并不一定都是无色的,如CuSO4溶液为蓝色;
(5)均一、稳定的液体并不一定郡是溶液,如水;
(6)溶液不一定都是液态的,如空气。
溶液与液体
(1)溶液并不仅局限于液态,只要是分散质高度分散(以单个分子、原子或离子状态存在)的体系均称为溶液。如锡、铅的合金焊锡,有色玻璃等称为固态溶液。气态的混合物可称为气态溶液,如空气。我们通常指的溶液是最熟悉的液态溶液,如糖水、盐水等。
(2)液体是指物质的形态之一。如通常状况下水是液体,液体不一定是溶液。
3. 溶液中溶质、溶剂的判断
(1)根据名称。溶液的名称一般为溶质的名称后加溶剂,即溶质在前,溶剂在后。如食盐水中食盐是溶质,水是溶剂,碘酒中碘是溶质,酒精是溶剂。
(2)若是固体或气体与液体相互溶解成为溶液。一般习惯将固体或气体看作溶质,液体看作溶剂。
(3)若是由两种液体组成的溶液,一般习惯上把量最多的看作溶剂,量少的看作溶质。
(4)其他物质溶解于水形成溶液时。无论,水量的多少,水都是溶剂。
(5)一般水溶液中不指明溶剂,如硫酸铜溶液,就是硫酸铜的水溶液,蔗糖溶液就是蔗糖的水溶液,所以未指明溶剂的一般为水。
(6)物质在溶解时发生了化学变化,那么在形成的溶液中,溶质是反应后分散在溶液中的生成物。如 Na2O,SO3分别溶于水后发生化学反应,生成物是 NaOH和H2SO4,因此溶质是NaOH和H2SO4,而不是 Na2O和SO3;将足量锌粒溶于稀硫酸中所得到的溶液中,溶质是硫酸锌(ZnSO4),若将蓝矾(CuSO4·5H2O) 溶于水,溶质是硫酸铜(CuSO4),而不是蓝矾。
溶液的导电性:
探究溶液导电性的实验:
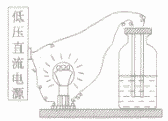
用如图所示的装置试验一些物质的导电性。可以养到蒸馏水、乙醉不导电,而盆酸、硫酸、氢氧化钠溶液、氢氧化钙溶液、氯化钠溶液、碳酸钠溶液均能导电。
酸、碱、盐溶液导电的原因:
酸、碱、盐溶于水,在水分子作用下,电离成自由移动的带正(或负)电的阳(或阴)离子(如下图所示)。因此酸、碱、盐的水溶液都能导电,导电的原因是溶液中存在自由移动的离子,而蒸馏水和乙醇中不存在自由移动的离子。
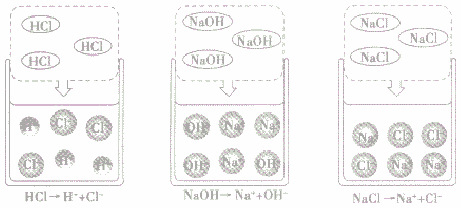
酸:
1. 定义:电离时生成的阳离子全部是H+的化合物
2. 常见的酸:HCl,H2SO4,HNO3,H3PO4。
碱:
1. 定义:电离时生成的阴离子全部是OH-的化合物
2. 常见的碱:NaOH,KOH,Cu(OH)2,Fe(OH)3等
盐:
1. 定义:电离时生成金属离子(包括NH4+)和酸根离子的化合物
2. 常见的盐:NaCO3,NaCl,NaSO4等
酸、碱、盐的比较:
1. 定义:电离时生成的阳离子全部是H+的化合物
2. 常见的酸:HCl,H2SO4,HNO3,H3PO4。
碱:
1. 定义:电离时生成的阴离子全部是OH-的化合物
2. 常见的碱:NaOH,KOH,Cu(OH)2,Fe(OH)3等
盐:
1. 定义:电离时生成金属离子(包括NH4+)和酸根离子的化合物
2. 常见的盐:NaCO3,NaCl,NaSO4等
酸、碱、盐的比较:
| 从化学组成看 | 从电离观点看 | 组成特点 | |
| 酸 | 由氢元素和酸根组成 | 电离时生成的阳离子全都是氢离子(H+)的化合物 | 一定含氢元素 |
| 碱 | 由金属元素和氢氧根组成(氨水也是碱) | 电离时生成的阴离子全都是氢氧根离子(OH-)的化合物 | 一定含氢、氧 元素 |
| 盐 | 含有金属元素(或NH4+) 和酸根 | 电离时能生成金属离子(或NH4+)和酸根离子的化合物 | 酸式盐中一定含氢元素,碱式盐中一定含氢、氧元素 |
氧化物:
1.定义:由两种元素组成,其中一种是氧元素的化合物(即由氧元素和另一种元素组成的化合物)。
2.分类:
(1)根据组成分类:
金属氧化物,如Na2O,CuO等
非金属氧化物,如CO2,NO等
(2)根据性质分类:
①酸性氧化物
能和碱反应生成盐和水的氧化物如CO2,SO3等
②碱性氧化物
能和酸反应生成盐和水的氧化物如CaO、Fe2O3等
③两性氧化物(初中不作要求)
④不成盐氧化物
不能直接反应生成盐的氧化物如CO,NO等
金属氧化物性质小结:
1.与水反应生成碱(可溶性金属氧化物)
Na2O+H2O==2NaOH
CaO+H2O==Ca(OH)2
2.与强酸反应
CaO+2HCI==CaCl2+H2O
Fe2O3+6HCl==2FeCl3+3H2O
Fe2O3+3H2SO4==Fe2(SO)3+3H2O
CuO+2HCl==CuCl2+H2O
CuO+H2SO4==CuSO4+H2O
3.与H2、CO或C反应
CuO+H2==Cu+H2O
2CuO+C==2Cu+CO2↑
CuO+CO==Cu+CO2
Fe2O3+3H2==2Fe+3H2O
2Fe2O3+3C==4Fe+3CO2↑
Fe2O3+3CO==2Fe+3CO2
Fe3O4+4H2==3Fe+4H2O
Fe3O4+2C==3Fe+2CO2↑
Fe3O4+4CO==3Fe+4CO2
非金属氧化物性质小结:
1.部分非金属氧化物与水反应生成相应的酸
CO2+H2O==H2CO3
SO2+H2O==H2SO3
2.与碱反应生成盐和水
Ca(OH)2+CO2==CaCO3↓+H2O
2NaOH+CO2==Na2CO3+H2O
Ca(OH)2+SO2==CaSO3↓+H2O
2NaOH+SO2==Na2SO3+H2O
易错点:
①酸性氧化物多数是非金属氧化物,但也可能是金属氧化物(如Mn2O7);碱性氧化物肯定是金属氧化物。
②非金属氧化物一般都是酸性氧化物,但H2O、CO、NO等不是酸性氧化物。
过氧化物:
常见的过氧化物有过氧化氢(H2O2)、过氧化钠 (Na2O2)。
过氧化氢俗称双氧水,在催化剂的催化作用下能分解生成水和氧气,常用于实验室制取氧气。过氧化氢具有极强的氧化性,可用作杀菌剂,漂白剂。
过氧化钠能与二氧化碳反应:2Na2O2+2CO2== 2Na2CO3+O2,根据该性质,可将过氧化钠用在坑道、潜艇或宁宙飞船等缺氧的场所,将人们呼出的CO2转换成O2,供给呼吸。
1.定义:由两种元素组成,其中一种是氧元素的化合物(即由氧元素和另一种元素组成的化合物)。
2.分类:
(1)根据组成分类:
金属氧化物,如Na2O,CuO等
非金属氧化物,如CO2,NO等
(2)根据性质分类:
①酸性氧化物
能和碱反应生成盐和水的氧化物如CO2,SO3等
②碱性氧化物
能和酸反应生成盐和水的氧化物如CaO、Fe2O3等
③两性氧化物(初中不作要求)
④不成盐氧化物
不能直接反应生成盐的氧化物如CO,NO等
金属氧化物性质小结:
1.与水反应生成碱(可溶性金属氧化物)
Na2O+H2O==2NaOH
CaO+H2O==Ca(OH)2
2.与强酸反应
CaO+2HCI==CaCl2+H2O
Fe2O3+6HCl==2FeCl3+3H2O
Fe2O3+3H2SO4==Fe2(SO)3+3H2O
CuO+2HCl==CuCl2+H2O
CuO+H2SO4==CuSO4+H2O
3.与H2、CO或C反应
CuO+H2==Cu+H2O
2CuO+C==2Cu+CO2↑
CuO+CO==Cu+CO2
Fe2O3+3H2==2Fe+3H2O
2Fe2O3+3C==4Fe+3CO2↑
Fe2O3+3CO==2Fe+3CO2
Fe3O4+4H2==3Fe+4H2O
Fe3O4+2C==3Fe+2CO2↑
Fe3O4+4CO==3Fe+4CO2
非金属氧化物性质小结:
1.部分非金属氧化物与水反应生成相应的酸
CO2+H2O==H2CO3
SO2+H2O==H2SO3
2.与碱反应生成盐和水
Ca(OH)2+CO2==CaCO3↓+H2O
2NaOH+CO2==Na2CO3+H2O
Ca(OH)2+SO2==CaSO3↓+H2O
2NaOH+SO2==Na2SO3+H2O
易错点:
①酸性氧化物多数是非金属氧化物,但也可能是金属氧化物(如Mn2O7);碱性氧化物肯定是金属氧化物。
②非金属氧化物一般都是酸性氧化物,但H2O、CO、NO等不是酸性氧化物。
过氧化物:
常见的过氧化物有过氧化氢(H2O2)、过氧化钠 (Na2O2)。
过氧化氢俗称双氧水,在催化剂的催化作用下能分解生成水和氧气,常用于实验室制取氧气。过氧化氢具有极强的氧化性,可用作杀菌剂,漂白剂。
过氧化钠能与二氧化碳反应:2Na2O2+2CO2== 2Na2CO3+O2,根据该性质,可将过氧化钠用在坑道、潜艇或宁宙飞船等缺氧的场所,将人们呼出的CO2转换成O2,供给呼吸。
发现相似题
与“下列叙述中,正确的是( )A.物质跟氧发生的反应,一定是氧...”考查相似的试题有:
- 根据你所做过的家庭小实验分析,如果向下列物质中加入适量水,充分搅拌,不能够得到溶液的是[ ]A.食盐B.植物油C.白糖D.纯...
- 下列物质放入水中,能形成溶液的是( )A.石灰石B.汽油C.食盐D.面粉
- 下列属于溶液且溶质是化合物的是[ ]A.稀硫酸B.碘酒C.液态氧气D.澄清石灰水
- 饮用矿泉水可分为碳酸水、硅酸水和锶水等几大类。此外还有锌、锂、溴、碘及硒等的矿泉水,这里“锌、锂、溴、碘、硒”指的是A....
- 按酸、碱、盐分类依次排列的一组是( )A.H2SO4NH3•H2O NaHCO3B.SO3Ba(OH)2KNO3C.HNO3CaO CuSO4D.NaOH H2CO3NH4Cl
- 如图是元素X的原子结构示意图。下列说法正确的是( )。A.该原子的核外电子数为12B.该原子最外电子层达到了稳定结构C.X属于...
- 某校实验室中四个药品橱存放的药品如表所示.该实验室新购进一些氯酸钾药品,应将它存放到( )药品橱甲乙丙丁药品镁铜锌盐酸...
- (1)空气、食盐、白酒是三种不同的物质,但它们同属于 这一类物质,从宏观角度说明的理由是 。(2)下列每组物质之间存在某...
- (10成都13) (6分)纽扣电池常用于手表等精密电子产品。下面是某常见纽扣电池中发生的反应:H2O+Zn+HgO=Zn(OH)2+Hg (1...
- 下列有关“化学之最”的叙述中错误的是:A.地壳中含量最多的金属元素是铁B.相同条件下密度最小的气体是氢气C.天然存在的最硬...