本试题 “写出下列反应的文字或符号表达式并回答有关问题:(1)红磷燃烧 ______;(2)铁丝在氧气里燃烧 ______,为了防止熔化物溅落下来使集气瓶炸裂,应当在瓶内 __...” 主要考查您对化学实验操作的注意事项
氧化反应
分解反应
化合反应
化学反应方程式的书写
文字表达式
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 化学实验操作的注意事项
- 氧化反应
- 分解反应
- 化合反应
- 化学反应方程式的书写
- 文字表达式
化学实验操作应遵循的七个原则:
1.“从下往上”原则。
2.“从左到右”原则。装配复杂装置应遵循从左到右顺序。
如上装置装配顺序为:发生装置→集气瓶→烧杯。
3.先“塞”后“定”原则。
4.“固体先放”原则。
5.“液体后加”原则。
6.先验气密性(装入药口前进行)原则。
7.后点酒精灯(所有装置装完后再点酒精灯)原则。
化学实验中的“七个关系”
(1)先后关系
①向试管中装人固体粉末时,先将试管倾斜,把盛药品的药匙送至试管底部,然后让试管直立,使药品全部落到试管底;向试管中放入块状固体时,先把试管横放,用镊子把药品放在试管口,然后将试管慢慢竖立起来使固体缓慢落到试管底。
②用胶头滴管吸取少量液体时,先在滴瓶外面挤压胶头排出滴管内的空气,然后再伸入滴瓶内松手吸取液体。
③用托盘天平称量药品时,先游码归零,再调节平衡,然后称量。
④给玻璃仪器加热时,先把仪器外壁擦干,然后再加热。
⑤给试管中的药品加热时,先使试管均匀受热,然后对盛放药品的部位固定加热。
(2)左右关系
①用托盘天平称量药品时,药品放在左盘,砝码放在右盘。
②连接实验装置时,应按从左到右(或自下而上)的顺序进行,拆除时顺序相反。
③橡胶塞和橡胶管与玻璃管连接时,左手拿橡胶塞或橡胶管,右手拿玻璃管(玻璃管一端用水润湿);给容器塞橡胶塞时,左手拿容器,右手拿塞子。
(3)上下关系
①给试管中的固体加热时,试管口应略向下倾斜;给试管中的液体加热时,试管口应向上倾斜(与桌面大约成45。角)。
②用试管夹夹持试管时,应从试管底部向上套,夹在试管的中上部。
③手拿试剂瓶倾斜液体试剂时,应让标签向上对着手心。
(4)正倒关系
①取试剂瓶里的药品时,拿下瓶塞,倒放在桌上。
②用胶头滴管取完液体时,胶头滴管应该正放 (保持胶头向上),而不能倒放或平放。
(5)多少关系
①实验时,如果没有说明药品用量,应取最少量,即液体取1~2mL,固体只需盖满试管底部。
②酒精灯内酒精的量不得超过酒精灯答积明了2/3。
③加热时,试管内液体的体积不能超过其容积的1/3,蒸发皿内液体的体积不能超过其容积的2/3。
(6)内外关系
①用洒精灯加热时.应该用外焰加热。
②使用胶头滴管向试管中滴加液体时,滴管应悬空在试管口的止上方,不能伸入试管内。
(7)高低关系
过滤时,滤纸的边缘要低于漏斗边缘,液面要低于滤。纸边缘
实验仪器使用的注意事项:
| 名称 | 图示 | 使用时的注意事项 |
| 试管 |  |
(1)可直接加热 (2)拿取试管时,用中指、食指、拇指夹住距试管口1/3 处:振荡时,用右手拇指、食指和中指夹持试骨的上端,使用腕力甩动试管底部。 (3)加热时要使用试管夹 (4)加热液体时,液体体积不超过试管容积的1/3·使试管与桌面成45。角。试管口不要对着自己或他人 (5)加热固体时试管口略向下倾斜 (6)加热前试管外壁擦干,加热时受热要均匀,不受碰到酒精灯的灯芯 (7)加热后不能骤冷,防止炸裂 |
| 蒸发皿 |  |
(1)用坩埚钳夹持,放在三脚架或铁架台的铁圈上直接加热 (2)加热后不能骤冷,防止破裂 (3)加热后不能直接放到实验桌上以免烫坏实验桌 (4)液体量多时可直接加热.量少或黏稠液体要垫石棉网加热 |
| 燃烧匙 |  |
(1)可以直接加热 (2)不可连续高温使用,以免端头脱焊掉落 (3)用后洗净擦拭干净.防止反应物与燃烧匙反应或生锈 |
| 烧杯 |  |
(1)加热时应放在石棉网上,使其受热士均匀,以防受热不均而炸裂 (2)溶解固体时要用玻璃棒轻轻搅拌.搅拌时玻璃捧不能接触器壁,防止碰破烧杯 |
| 锥形瓶,烧瓶(圆底,平底) |  |
加热时需垫上石棉网,以防受热不均而炸裂 |
| 酒精灯 |  |
(1)酒精量不得超过酒精灯容积的2/3,不得少于1/4。量多受热易溢出,量少则酒精蒸气易引火爆炸 (2)禁止向燃着的酒精灯里添加酒精;点燃酒精灯用火柴,禁止用燃着的酒精灯去引燃另一盏酒精灯,防止酒精溢出发生火灾 (3)应用外焰加热,外焰酒精充分燃烧,温度高 (4)熄灭时不能用嘴吹灭,应用灯帽盖灭而且要反复盖两次,目的是防止火焰进入灯内引燃酒精失火,同时防止下次用时打不开 |
| 集气瓶 |  |
(1)不允许加热,防止受热破裂 (2)用于物质和气体的某些放热反应时,集气瓶内要放人少量水或细沙,以防止受热炸裂 (3)集气瓶和广口瓶外形相似,但磨口的部位不同,集气瓶磨砂在瓶口上表面,广口瓶磨砂在瓶口内侧 |
| 滴管,滴瓶 |  |
(1)瓶塞不能弄脏、弄乱,防止沾污试剂: (2)盛放碱液改用胶塞: (3)有色瓶盛见光易分解或不太稳定的试剂: (4)滴瓶上的滴管专用,不可冲洗; |
| 细口瓶 |  | |
| 广口瓶 |  | |
| 托牌天平 | 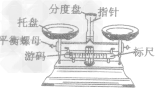 |
(1)使用前先调零: (2)不能在托盘上直接放置药品,用称量纸或小烧杯称量; (3)左物右码,添加砝码顺序应从大到小: (4)用镊子取用砝码、拨游码 |
| 量筒 |  |
(1)不可加热,不可作反应容器: (2)根据液体的量选择规格; (3)读数时,视线应与凹液面最低处保持水平 |
| 普通漏斗 |  |
(1)过滤时,要使滤纸边缘低于漏斗边缘,漏斗内的液面要低于滤纸边缘,用水湿润滤纸并使之紧贴漏斗内壁.中间不能留有气泡 (2)过滤时要用玻璃棒引流 |
| 长颈漏斗 |  |
长颈漏斗的下端管口要插入液面以下,形成液封,避免产生的气体从长颈漏斗中逸出 |
| 分液漏斗 |  |
分液漏斗的下端不必插入液面以下 |
| 铁架台 | 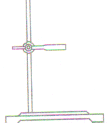 |
(1)铁圈、铁夹方向应与铁架台底盘同侧; (2)铁夹夹在试管中上部; (3)夹持玻璃仪器时,勿过松或过紧,应以恰好使玻璃仪器不能移动,以防仪器脱落或夹碎 |
| 试管夹 |  |
(1)夹在试管中上部; (2)从试管底部套入、取出; (3)拇指不要按在试管夹的短柄上 |
| 坩埚钳 |  |
(1)尖端向上平放在实验台上; (2)温度高时应放往石棉网网上 |
| 水槽 |  |
(1)水不要加满,防止实验时有水溢出 (2)防止打碎,不能加热 |
| 药匙 |  |
(1)每次用完及时用纸擦干净 (2)保持洁净、干燥 |
| 玻璃棒 |  |
(1)搅拌时切勿撞击器壁,以免碰破容器; (2)注意随时洗涤、擦净; (3)过滤或转移液体时,使液体沿玻璃棒流下,防止液体洒出或溅出 |
| 石棉网 |  |
不能与水接触,防止石棉脱落或铁丝生锈 |
| 试管刷 |  |
刷洗试管时,不要用力过猛,以免损坏容器 |
| 温度计 |  |
(1)温度计不允许测量超过它的最高量程的温度 (2)温度计不能当搅拌器使用,以防水银球破裂 (3)刚刚测量过高温的温度计不可以立即用冷水冲洗,以防骤冷破裂 |
化学实验基本操作口诀:
固粉需匙或纸槽,一横二送三直立。
块固还是镊子好,一横二放三慢竖。
液体应盛细口瓶,手贴标签再倾倒。
量筒读数切面平,仰视偏低俯视高。
滴管滴加捏胶头,垂直悬空不沾污。
不平不倒不乱放,用完清洗莫忘记。
托盘天平须放平,游码旋螺针对中。
左放物来右放码,镊子夹大后夹小。
试纸测液先剪小,玻棒蘸液测最好。
试纸测气先湿润,粘在棒上向气靠。
酒灯加热用外焰,三分之二为界限。
硫酸入水搅不停,慢慢注入防沸溅。
实验先查气密性,隔网加热杯和瓶。
排水集气完毕后,先撤导管后移灯。
化学实验意外事故的处理:
| 意外事故 | 处理方法 |
| 使用酒精灯时烫伤 | 立即用水冲洗烫伤处,再涂上烫伤膏 |
| 使用玻璃管时划伤手指 | 立即进行消毒再包扎处理 |
| 眼睛里溅进了酸或碱溶液 | 立即用水冲洗,切不可用手揉眼睛,洗的时候要眨眼睛,必要时请医生治疗 |
| 洒在桌面上的酒精燃烧起来 | 立即用湿抹布或沙子扑灭 |
| 浓硫酸飞溅到皮肤上 | 立即用大量水冲洗再涂上3%~5%的小苏打溶液 |
| 误服氯化钡溶液 | 立即喝大量鲜牛奶或鸡蛋清 |
| NaOH溶液溅到皮肤上 | 立即用大量水冲洗再涂上硼酸溶 |
实验安全操作的注意事项:
(1)防倒流倒:吸用试管加热固体时,试管底部要略高于管口,如用KClO3和MnO2、KMnO4制取氧气加热法制取并用排水法收集气体时容易发生倒吸,要注意熄灯顺序。
(2)防爆炸:点燃可燃性气体或用CO、H2还原Fe2O3、CuO之前,要检验气体纯度。
(3)防暴沸:加热液体或蒸馏时常在加热的装置中加入沸石或碎瓷片,防止液体暴沸。
(4)防失火:实验室中的可燃物质一定要远离火源。
(5)防腐蚀:强酸、强碱对皮肤有强烈的腐蚀作用,如果皮肤上沾有强酸、强碱要用水冲洗,再涂抹3%一5%NaHCO3 溶液、硼酸,
(6)防中毒:在制取或使用有毒气体时,应在通风橱中进行,注意尾气处理。如用CO还原Fe2O3、CuO要处理好尾气.
(7)防炸裂:普通玻璃制品都有受热不均匀易炸裂的特性,因此:
①试管加热时先要预热;
②做固体在气体中燃烧实验时要在集气瓶底预留少量水或铺一层细沙;
③注意防止倒吸。
(8)防堵塞:加热高锰酸钾制氧气时,在试管口放一团棉花。
(9)防污染:
①已取出的未用完的试剂一般不放回原瓶(块状固体。如钠、白磷除外);
②用胶头滴管滴加液体时,不伸入瓶内,不接触试管壁;
③取用试剂时试剂瓶盖倒放子桌面上;
④药匙和胶头滴管尽可能专用(或洗净、擦干后再取其他药品);
⑤废液及时处理。
(10)防意外:
(1)中毒事故防止和处理一氧化碳中毒时应迅速离开所处房间,到通风良好的地方呼吸新鲜空气。误食重金属盐(如铜盐、铅盐、银盐等)应立即服用生蛋白或生牛奶。
(2)火灾处理
①酒精及其他易燃有机物小面积失火,应迅速用湿抹布扑盖;
②钠、磷等失火宜用沙土扑盖;
③会用干粉及泡沫火火器;
④拔打火警电话“119”、急救电话 “120”,也可拨“110”求助;
⑤因电失火应先切断电源,再实施灭火。
定义:
氧化反应:物质与氧发生的化学反应,如S+O2 SO2;H2+CuO
SO2;H2+CuO H2O+Cu.
H2O+Cu.
氧化反应与缓慢氧化:
氧化反应:物质与氧发生的化学反应,如S+O2
 SO2;H2+CuO
SO2;H2+CuO H2O+Cu.
H2O+Cu.氧化反应与缓慢氧化:
| 氧化反应 | 缓慢氧化 | |
| 概念 | 物质与氧(包括氧气)发生的化学反应 | 物质与氧气发生的缓慢的,不易察觉的氧化反应 |
| 举例 | 所有与氧气发生的反应 | 铁生锈,食物腐烂 |
| 联系 | 氧化反应包括剧烈氧化和缓慢氧化两种 | |
| 相同点 | ①都是氧化反应②都放出热量 | |
概念:
由一种物质生成两种或两种以上物质的反应
特征:
一变多
表达式:
A = B + C
初中常见的分解反应:
按产物种类多少分类:
一、加热分解的产物有两种
1.分解成两种单质
⑴气态氢化物的分解
碘化氢的分解2HI=H2↑+I2
⑵氯化银的分解
氯化银的分解2AgCl=2Ag+Cl2↑
⑶电解
电解水2H2O 2H2↑+O2↑
2H2↑+O2↑
2.分解成两种化合物
⑴不稳定盐类的分解
碳酸钙的高温分解CaCO3 CaO+CO2↑
CaO+CO2↑
⑵不稳定弱碱的分解
氢氧化铝受热分解2Al(OH)3=Al2O3+3H2O
⑶不稳定弱酸的分解
碳酸的分解H2CO3=H2O+CO2↑
⑷含结晶水的盐类的脱水
十水碳酸钠的风化Na2CO3·10H2O=Na2CO3+10H2O
3.分解成一种单质和一种化合物
⑴不太稳定的盐类的分解
氯酸钾的催化分解2KClO3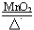 2KCl+3O2↑
2KCl+3O2↑
⑵不稳定酸的分解
次氯酸的分解2HClO=2HCl+O2
⑶双氧水的分解
受热(或以二氧化锰为催化剂)分解2H2O2=2H2O+O2
4.有机物的分解
甲烷的裂解2CH4=C2H2+3H2
二、加热分解的产物有三种
1.不稳定盐类的分解
⑴碳酸氢钠受热分解2NaHCO3=Na2CO3+CO2↑+H2O
⑵亚硫酸的酸式强碱盐受热分解
亚硫酸氢钠受热分解 2NaHSO3=Na2SO4+SO2↑+H2O
⑶铵盐的受热分解
碳酸铵受热分解
(NH4)2CO3=2NH3↑+H2O↑+CO2↑
⑷高锰酸钾受热分解
2KMnO4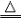 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
⑸硝酸盐的受热分解
硝酸银的受热分解2AgNO3=2Ag+2NO2↑+O2↑
2.硝酸的分解
4HNO3=4NO2+O2+2H2O
3.电解水溶液
⑴电解饱和食盐水
2NaCl+2H2O=2NaOH+H2↑+Cl2↑
按反应物种类进行分类:
1.酸的分解反应。
⑴含氧酸=非金属氧化物+水 如H2CO3=CO2↑+H2O,H2SO3=SO2↑+H2O
⑵某些含氧酸的分解比较特殊, 如
硝酸的分解: 4HNO3(浓)=4NO2↑+O2↑+2H2O,
次氯酸分解 2HClO=2HCl+O2↑
磷酸脱水 4H3PO4 (HPO3)4+4H2O↑ ;
(HPO3)4+4H2O↑ ;
2H3PO4 H4P2O7+H2O↑
H4P2O7+H2O↑
3H3PO4 H5P3O10+2H2O↑
H5P3O10+2H2O↑
2.碱的分解反应:
活泼金属的氢氧化物较难分解,难溶性碱一般都较易分解: 2Al(OH)3=Al2O3+3H2O, 2Fe(OH)3=Fe2O3+3H2O, Cu(OH)2=CuO十H2O。
3.盐的分解反应:
碳酸盐、硝酸盐、铵盐一般都较易分解,且反应表现出一定的规律性。
⑴碳酸盐的分解:
碳酸盐=金属氧化物十CO2↑ 如CaCO3 CaO+CO2↑,CuCO3
CaO+CO2↑,CuCO3 CuO+CO2↑
CuO+CO2↑
K2CO3、Na2CO3比较稳定,很难分解,而其酸式盐较易分解:
2NaHCO3=Na2CO3+CO2↑+H2O
Ca(HCO3)2=CaCO3+CO2↑+H2O
⑵硝酸盐的分解反应。硝酸盐受热均易分解,并放出氧气,其规律大体如下:
活动性强的金属(K、Ca、Na)硝酸盐=亚硝酸盐+O2↑:
如 2KNO3=2KNO2+O2↑。
处于活动性顺序表中间的金属(Mg、Cu等)的硝酸盐=金属氧化物+NO2↑+O2↑:
如2Mg(NO3)2=2MgO+4NO2↑+O2↑ 2Cu(NO3)2=2CuO+4NO2↑+O2↑
不活动金属(Hg、Ag、Au)的硝酸盐=金属+NO2↑+O2↑:
如 Hg(NO3)2=Hg+2NO2↑+O2↑; 2AgNO3=2Ag+2NO2↑+O2↑
⑶铵盐的分解反应。铵盐受热易分解,一般都有氨气放出:
如(NH4)2SO4=2NH3↑+H2SO4 ;NH4HCO3=NH3↑+CO2↑+H2O。
⑷其它盐类的分解反应
如 2KClO3=2KCl+3O2↑ 2KMnO4=K2MnO4+MnO2+O2↑
4.氧化物的分解反应:
非金属氧化物一般不容易发生分解反应 2H2O2=H2↑+O2↑
金属氧化物一般分解的规律是: 金属活动顺序表中,排在铜后的金属氧化物受热易分解:
如 2HgO=2Hg+O2↑,2Ag2O=4Ag+O2↑
活泼的金属氧化物,给它们熔化态通电流可使其分解:
如2Al2O3(熔化)=4Al+3O2↑
由一种物质生成两种或两种以上物质的反应
特征:
一变多
表达式:
A = B + C
初中常见的分解反应:
按产物种类多少分类:
一、加热分解的产物有两种
1.分解成两种单质
⑴气态氢化物的分解
碘化氢的分解2HI=H2↑+I2
⑵氯化银的分解
氯化银的分解2AgCl=2Ag+Cl2↑
⑶电解
电解水2H2O
 2H2↑+O2↑
2H2↑+O2↑2.分解成两种化合物
⑴不稳定盐类的分解
碳酸钙的高温分解CaCO3
 CaO+CO2↑
CaO+CO2↑ ⑵不稳定弱碱的分解
氢氧化铝受热分解2Al(OH)3=Al2O3+3H2O
⑶不稳定弱酸的分解
碳酸的分解H2CO3=H2O+CO2↑
⑷含结晶水的盐类的脱水
十水碳酸钠的风化Na2CO3·10H2O=Na2CO3+10H2O
3.分解成一种单质和一种化合物
⑴不太稳定的盐类的分解
氯酸钾的催化分解2KClO3
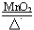 2KCl+3O2↑
2KCl+3O2↑⑵不稳定酸的分解
次氯酸的分解2HClO=2HCl+O2
⑶双氧水的分解
受热(或以二氧化锰为催化剂)分解2H2O2=2H2O+O2
4.有机物的分解
甲烷的裂解2CH4=C2H2+3H2
二、加热分解的产物有三种
1.不稳定盐类的分解
⑴碳酸氢钠受热分解2NaHCO3=Na2CO3+CO2↑+H2O
⑵亚硫酸的酸式强碱盐受热分解
亚硫酸氢钠受热分解 2NaHSO3=Na2SO4+SO2↑+H2O
⑶铵盐的受热分解
碳酸铵受热分解
(NH4)2CO3=2NH3↑+H2O↑+CO2↑
⑷高锰酸钾受热分解
2KMnO4
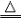 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑ ⑸硝酸盐的受热分解
硝酸银的受热分解2AgNO3=2Ag+2NO2↑+O2↑
2.硝酸的分解
4HNO3=4NO2+O2+2H2O
3.电解水溶液
⑴电解饱和食盐水
2NaCl+2H2O=2NaOH+H2↑+Cl2↑
按反应物种类进行分类:
1.酸的分解反应。
⑴含氧酸=非金属氧化物+水 如H2CO3=CO2↑+H2O,H2SO3=SO2↑+H2O
⑵某些含氧酸的分解比较特殊, 如
硝酸的分解: 4HNO3(浓)=4NO2↑+O2↑+2H2O,
次氯酸分解 2HClO=2HCl+O2↑
磷酸脱水 4H3PO4
 (HPO3)4+4H2O↑ ;
(HPO3)4+4H2O↑ ;2H3PO4
 H4P2O7+H2O↑
H4P2O7+H2O↑ 3H3PO4
 H5P3O10+2H2O↑
H5P3O10+2H2O↑ 2.碱的分解反应:
活泼金属的氢氧化物较难分解,难溶性碱一般都较易分解: 2Al(OH)3=Al2O3+3H2O, 2Fe(OH)3=Fe2O3+3H2O, Cu(OH)2=CuO十H2O。
3.盐的分解反应:
碳酸盐、硝酸盐、铵盐一般都较易分解,且反应表现出一定的规律性。
⑴碳酸盐的分解:
碳酸盐=金属氧化物十CO2↑ 如CaCO3
 CaO+CO2↑,CuCO3
CaO+CO2↑,CuCO3 CuO+CO2↑
CuO+CO2↑K2CO3、Na2CO3比较稳定,很难分解,而其酸式盐较易分解:
2NaHCO3=Na2CO3+CO2↑+H2O
Ca(HCO3)2=CaCO3+CO2↑+H2O
⑵硝酸盐的分解反应。硝酸盐受热均易分解,并放出氧气,其规律大体如下:
活动性强的金属(K、Ca、Na)硝酸盐=亚硝酸盐+O2↑:
如 2KNO3=2KNO2+O2↑。
处于活动性顺序表中间的金属(Mg、Cu等)的硝酸盐=金属氧化物+NO2↑+O2↑:
如2Mg(NO3)2=2MgO+4NO2↑+O2↑ 2Cu(NO3)2=2CuO+4NO2↑+O2↑
不活动金属(Hg、Ag、Au)的硝酸盐=金属+NO2↑+O2↑:
如 Hg(NO3)2=Hg+2NO2↑+O2↑; 2AgNO3=2Ag+2NO2↑+O2↑
⑶铵盐的分解反应。铵盐受热易分解,一般都有氨气放出:
如(NH4)2SO4=2NH3↑+H2SO4 ;NH4HCO3=NH3↑+CO2↑+H2O。
⑷其它盐类的分解反应
如 2KClO3=2KCl+3O2↑ 2KMnO4=K2MnO4+MnO2+O2↑
4.氧化物的分解反应:
非金属氧化物一般不容易发生分解反应 2H2O2=H2↑+O2↑
金属氧化物一般分解的规律是: 金属活动顺序表中,排在铜后的金属氧化物受热易分解:
如 2HgO=2Hg+O2↑,2Ag2O=4Ag+O2↑
活泼的金属氧化物,给它们熔化态通电流可使其分解:
如2Al2O3(熔化)=4Al+3O2↑
概念:指的是由两种或两种以上的物质生成一种新物质的反应。其中部分反应为氧化还原反应,部分为非氧化还原反应。 此外,化合反应一般释放出能量。
注意:不是所有的化合反应都是放热反应。
特征:多变一
表达式:a+b=ab
初中常见化合反应:
1.金属+氧气→金属氧化物
很多金属都能跟氧气直接化合。例如常见的金属铝接触空气,它的表面便能立即生成一层致密的氧化膜,可阻止内层铝继续被氧化。4Al+3O2=2Al2O3
2.非金属+氧气→非金属氧化物 经点燃,许多非金属都能在氧气里燃烧,如:C+O2 CO2
CO2
3.金属+非金属→无氧酸盐 许多金属能与非金属氯、硫等直接化合成无氧酸盐。如 2Na+Cl2 2NaCl
2NaCl
4.氢气+非金属→气态氢化物 因氢气性质比较稳定,反应一般需在点燃或加热条件下进行。如 2H2+O2 2H2O
2H2O
5.碱性氧化物+水→碱. 多数碱性氧化物不能跟水直接化合。判断某种碱性氧化物能否跟水直接化合,一般的方法是看对应碱的溶解性,对应的碱是可溶的或微溶的,则该碱性氧化物能与水直接化合。如: Na2O+H2O=2NaOH. 对应的碱是难溶的,则该碱性氧化物不能跟水直接化合。如CuO、Fe2O3都不能跟水直接化合。
6.酸性氧化物+水→含氧酸. 除SiO2外,大多数酸性氧化物能与水直接化合成含氧酸。如: CO2+H2O=H2CO3
7.碱性氧化物+酸性氧化物→含氧酸盐 Na2O+CO2=Na2CO3。大多数碱性氧化物和酸性氧化物可以进行这一反应。其碱性氧化物对应的碱碱性越强,酸性氧化物对应的酸酸性越强,反应越易进行。
8.氨+氯化氢→氯化铵 氨气易与氯化氢化合成氯化铵。如: NH3+HCl=NH4Cl
9.硫和氧气在点燃的情况下形成二氧化硫 S+O2 SO2
SO2
10.特殊化合反应
公式 A+B+…+N→X(有些化合反应属于燃烧反应)
例如:铁+氧气 四氧化三铁 3Fe+2O2
四氧化三铁 3Fe+2O2 Fe3O4
Fe3O4
注意:不是所有的化合反应都是放热反应。
特征:多变一
表达式:a+b=ab
初中常见化合反应:
1.金属+氧气→金属氧化物
很多金属都能跟氧气直接化合。例如常见的金属铝接触空气,它的表面便能立即生成一层致密的氧化膜,可阻止内层铝继续被氧化。4Al+3O2=2Al2O3
2.非金属+氧气→非金属氧化物 经点燃,许多非金属都能在氧气里燃烧,如:C+O2
 CO2
CO2 3.金属+非金属→无氧酸盐 许多金属能与非金属氯、硫等直接化合成无氧酸盐。如 2Na+Cl2
 2NaCl
2NaCl 4.氢气+非金属→气态氢化物 因氢气性质比较稳定,反应一般需在点燃或加热条件下进行。如 2H2+O2
 2H2O
2H2O 5.碱性氧化物+水→碱. 多数碱性氧化物不能跟水直接化合。判断某种碱性氧化物能否跟水直接化合,一般的方法是看对应碱的溶解性,对应的碱是可溶的或微溶的,则该碱性氧化物能与水直接化合。如: Na2O+H2O=2NaOH. 对应的碱是难溶的,则该碱性氧化物不能跟水直接化合。如CuO、Fe2O3都不能跟水直接化合。
6.酸性氧化物+水→含氧酸. 除SiO2外,大多数酸性氧化物能与水直接化合成含氧酸。如: CO2+H2O=H2CO3
7.碱性氧化物+酸性氧化物→含氧酸盐 Na2O+CO2=Na2CO3。大多数碱性氧化物和酸性氧化物可以进行这一反应。其碱性氧化物对应的碱碱性越强,酸性氧化物对应的酸酸性越强,反应越易进行。
8.氨+氯化氢→氯化铵 氨气易与氯化氢化合成氯化铵。如: NH3+HCl=NH4Cl
9.硫和氧气在点燃的情况下形成二氧化硫 S+O2
 SO2
SO210.特殊化合反应
公式 A+B+…+N→X(有些化合反应属于燃烧反应)
例如:铁+氧气
 四氧化三铁 3Fe+2O2
四氧化三铁 3Fe+2O2 Fe3O4
Fe3O4化学方程式的书写原则遵循两个原则:
一是必须以客观事实为基础,绝不能凭空设想、主观臆造事实上不存在的物质和化学反应;
二是遵循质量守恒定律,即方程式两边各种原子的种类和数目必须相等。
书写化学方程式的具体步骤:
(1)写:根据实验事实写出反应物和生成物的化学式。反应物在左,生成物在右,中间用横线连接,如: H2+O2——H2O,H2O——H2+O2。
(2)配:根据反应前后原子的种类和数目不变的原则,在反应物和生成物的化学式前配上适当的化学计量数,使各种元素的原子个数在反应前后相等,然后将横线变成等号。配平后,化学式前的化学计量数之比应是最简整数比,如:2H2+O2=2H2O,2H2O= 2H2+O2。
(3)注:注明反应条件【如点燃、加热(常用“△”表示)、光照、通电等〕和生成物的状态(气体用“↑”。沉淀用“↓”。)。如:2H2+O2 2H2O,2H2O
2H2O,2H2O 2H2↑+O2↑。
2H2↑+O2↑。
化学计量数:
化学计量数指配平化学方程式后,化学式前面的数字。在化学方程式中,各化学式前的化学计量数之比应是最简整数比,计数量为1时,一般不写出。
书学化学方程式的常见错误:
书写化学方程式时条件和气体、沉淀符号的使用:
(1).“△”的使用
①“△”是表示加热的符号,它所表示的温度一般泛指用酒精灯加热的温度。
②如果一个反应在酒精灯加热的条件下能发生,书写化学方程式时就用“△”,如:2KMnO4 K2MnO4+MnO2+O2↑。
K2MnO4+MnO2+O2↑。
③如果一个反应需要的温度高于用酒精灯加热的温度,一般用“高温”表示;如:CaCO3 CaO+ CO2↑
CaO+ CO2↑
(2)“↑”的使用
①“↑”表示生成物是气态,只能出现在等号的右边。
②当反应物为固体、液体,且生成的气体能从反应体系中逸出来,气体化学式后应该加“↑”。如Fe+ 2HCl==FeCl2+H2↑。
③当反应物是溶液时,生成的气体容易溶于水而不能从反应体系中逸出来,则不用“↑”,如:H2SO4+ BaCl2==FeCl2+2HCl
④只有生成物在该反应的温度下为气态,才能使用“↑”。
⑤若反应物中有气态物质,则生成的气体不用标 “↑”。如:C+O2 CO2
CO2
(3)“↓”使用
①“↓”表示难溶性固体生成物,只能出现在等号的右边
②当反应在溶液中进行,有沉淀生成时,用 “↓”,如:AgNO3+HCl==AgCl↓+HNO3
③当反应不在溶液中进行,尽管生成物有不溶性固体,也不用标“↓”,如:2Cu+O2 2CuO
2CuO
④反应在溶液中进行,若反应物中有难溶性物质,生成物中的难溶性物质后面也不用标“↓”。如:Fe +CuSO4==FeSO4+Cu.
化学方程式中“↑”和“↓”的应用:
①“↑”或“↓”是生成物状态符号,无论反应物是气体还是固体,都不能标“↑”或“↓”;
②若反应在溶液中进行且生成物中有沉淀,则使用“↓”;若不在溶液中进行,无论生成物中是否有固体或难溶物,都不使用“↓”;
③常温下,若反应物中无气体,生成物中有气体.
提取信息书写化学方程式的方法:
书写信息型化学方程式是中考热点,题目涉及社会、生产、生活、科技等各个领域,充分体现了化学学科的重要性,并考查了同学们接受信息、分析问题和解决问题的能力。解答这类题日的关键是掌握好化学方程式的书写步骤,可按两步进行:首先正确书写反应物和生成物的化学式,并注明反应条件及生成物状态;第二步就是化学方程式的配平。
一是必须以客观事实为基础,绝不能凭空设想、主观臆造事实上不存在的物质和化学反应;
二是遵循质量守恒定律,即方程式两边各种原子的种类和数目必须相等。
书写化学方程式的具体步骤:
(1)写:根据实验事实写出反应物和生成物的化学式。反应物在左,生成物在右,中间用横线连接,如: H2+O2——H2O,H2O——H2+O2。
(2)配:根据反应前后原子的种类和数目不变的原则,在反应物和生成物的化学式前配上适当的化学计量数,使各种元素的原子个数在反应前后相等,然后将横线变成等号。配平后,化学式前的化学计量数之比应是最简整数比,如:2H2+O2=2H2O,2H2O= 2H2+O2。
(3)注:注明反应条件【如点燃、加热(常用“△”表示)、光照、通电等〕和生成物的状态(气体用“↑”。沉淀用“↓”。)。如:2H2+O2
 2H2O,2H2O
2H2O,2H2O 2H2↑+O2↑。
2H2↑+O2↑。 化学计量数:
化学计量数指配平化学方程式后,化学式前面的数字。在化学方程式中,各化学式前的化学计量数之比应是最简整数比,计数量为1时,一般不写出。
书学化学方程式的常见错误:
| 常见错误 | 违背规律 |
| 写错物质的化学式 | 客观事实 |
| 臆造生成物或事实上不存在的化学反应 | |
| 写错或漏泄反应条件 | |
| 化学方程式没有配平 | 质量守恒 |
| 漏标多标“↑”、“↓”符号 | —— |
书写化学方程式时条件和气体、沉淀符号的使用:
(1).“△”的使用
①“△”是表示加热的符号,它所表示的温度一般泛指用酒精灯加热的温度。
②如果一个反应在酒精灯加热的条件下能发生,书写化学方程式时就用“△”,如:2KMnO4
 K2MnO4+MnO2+O2↑。
K2MnO4+MnO2+O2↑。 ③如果一个反应需要的温度高于用酒精灯加热的温度,一般用“高温”表示;如:CaCO3
 CaO+ CO2↑
CaO+ CO2↑(2)“↑”的使用
①“↑”表示生成物是气态,只能出现在等号的右边。
②当反应物为固体、液体,且生成的气体能从反应体系中逸出来,气体化学式后应该加“↑”。如Fe+ 2HCl==FeCl2+H2↑。
③当反应物是溶液时,生成的气体容易溶于水而不能从反应体系中逸出来,则不用“↑”,如:H2SO4+ BaCl2==FeCl2+2HCl
④只有生成物在该反应的温度下为气态,才能使用“↑”。
⑤若反应物中有气态物质,则生成的气体不用标 “↑”。如:C+O2
 CO2
CO2 (3)“↓”使用
①“↓”表示难溶性固体生成物,只能出现在等号的右边
②当反应在溶液中进行,有沉淀生成时,用 “↓”,如:AgNO3+HCl==AgCl↓+HNO3
③当反应不在溶液中进行,尽管生成物有不溶性固体,也不用标“↓”,如:2Cu+O2
 2CuO
2CuO ④反应在溶液中进行,若反应物中有难溶性物质,生成物中的难溶性物质后面也不用标“↓”。如:Fe +CuSO4==FeSO4+Cu.
化学方程式中“↑”和“↓”的应用:
①“↑”或“↓”是生成物状态符号,无论反应物是气体还是固体,都不能标“↑”或“↓”;
②若反应在溶液中进行且生成物中有沉淀,则使用“↓”;若不在溶液中进行,无论生成物中是否有固体或难溶物,都不使用“↓”;
③常温下,若反应物中无气体,生成物中有气体.
提取信息书写化学方程式的方法:
书写信息型化学方程式是中考热点,题目涉及社会、生产、生活、科技等各个领域,充分体现了化学学科的重要性,并考查了同学们接受信息、分析问题和解决问题的能力。解答这类题日的关键是掌握好化学方程式的书写步骤,可按两步进行:首先正确书写反应物和生成物的化学式,并注明反应条件及生成物状态;第二步就是化学方程式的配平。
概念:用文字表示化学反应的式子
文字表达式的书写步骤:
(1)写:根据反应事实写出反应物和生成物
(2)注:注明反应条件:[点燃,加热,光照,通电等]
文字表达式的书写步骤:
(1)写:根据反应事实写出反应物和生成物
(2)注:注明反应条件:[点燃,加热,光照,通电等]
发现相似题
与“写出下列反应的文字或符号表达式并回答有关问题:(1)红磷燃...”考查相似的试题有:
- (1)有下列仪器:A.量筒、B.玻璃棒、C.药匙、D.蒸发皿、 E.托盘天平,请用仪器标号回答:a.可量取液体体积的是_______。b...
- 手机应用越来越广泛,内部安装的电池多为锂电池,锂电池工作时发生的化学反应可表示为:Li+MnO2=LiMnO2。该反应的基本类型是...
- 蛋白质是人类重要的营养物质,它是由多种氨基酸构成的化合物,丙氨酸是其中的一种。下列有关丙氨酸的叙述错误的是 ( )A.丙氨...
- 化学和生产、生活紧密相关.请你用化学方程式回答下列问题.(1)生石灰常用作食品干燥剂,原因是______.(2)二氧化碳可用...
- (1)用化学符号表示:三个氢原子 ;两个氢分子 ;正一价的氢元素 .(2)重水的主要用途是在核反应堆中作减速剂,一个重水分...
- 下列括号中对日常生活的变化判断正确的是( )A.咀嚼馒头感到甜味(化学变化)B.为(物理变化)C.用汽油清洗油污(化学变化)D....
- 鱼是人们非常喜爱并经常食用的食品.剖鱼时若不小心弄破了鱼胆,胆汁沾在鱼肉上,就会使鱼肉带有苦味而影响人的食欲.但汁中...
- 根据要求写出下列化学方程式.(1)“曾青得铁则化为铜”原理的化学方程式为______;该反应的基本类型是______.(2)氢氧化钠...
- 有一包粉末A,已知其中可能含有氢氧化铜、硝酸铵、氯化铜、硫酸铵四种物质中的两种或多种.为了鉴别它,做了下列实验:实验①...
- 铁在氧气中燃烧 ______,基本反应类型为:______.