本试题 “用下图装置做趣味实验:在用胶塞塞紧的烧瓶里充满某种气体(X),烧瓶内导管的一端事先已绑好了一个气球。拔开胶塞,迅速倒入另一种溶液(Y),再立即塞紧胶...” 主要考查您对家庭小实验、趣味实验
氧气的性质
氢气的性质
二氧化硫的性质
酸的性质
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 家庭小实验、趣味实验
- 氧气的性质
- 氢气的性质
- 二氧化硫的性质
- 酸的性质
“家庭小实验”是指利用家庭生活用品来进行化学实验,从而对化学进行学习和探讨的活动。它具有趣味性、探究性、规范性、普及性等特点。
常见的家庭小实验:
(1)
(2)
(3)
(4)
(5)
(6)
(7)
(8)
(9)
(10)
(11)
(12)
(13)
(14)
(15)
常见的家庭小实验:
(1)
| 序号 | 1 |
| 实验名称 | 点不着的“纸” |
| 家庭用到的实验器材及药品 | 铜棒两张相同的长条白纸火柴 |
| 实验步骤 | 1、用火柴直接点其中的一张纸条; 2、将另一张纸条先以螺旋形紧紧地缠绕在铜棒上,再去点燃; |
| 实验现象 | 1、纸条迅速燃烧 2、纸条没有燃烧 |
| 实验结论 | 因为铜具有良好的导热性,将加热处的热量迅速传导散失,使其温度达不到纸条的着火点而点不着。 |
| 注意事项 | 铜棒是金属,有良好的导热性,注意勿烫手。 |
(2)
| 序号 | 2 |
| 实验名称 | “神奇”的手帕 |
| 家庭用到的实验器材及药品 | 酒精的水溶液(1:1)棉手帕钳子(两只)火柴 |
| 实验步骤 | 把棉手帕放入用酒精与水以1:1配成的溶液里浸透,然后轻挤,用两只钳子分别夹住手帕两角,放到火上点燃,等火焰减小时迅速摇动手帕,使火焰熄灭。 |
| 实验现象 | 手帕依旧完好如初。 |
| 实验结论 | 燃烧时,酒精的火焰在水层外,吸附在纤维空隙里的水分吸收燃烧放出的热量而蒸发,手帕上的温度达不到纤维的着火点,因而手帕烧不坏。 |
| 注意事项 | 由于火焰温度较高,注意别烧伤手及对着其他人,且远离其它可燃物。 |
(3)
| 序号 | 3 |
| 实验名称 | 金属性质“谁更强” |
| 家庭用到的实验器材及药品 | 白醋、铝片、铁片、铜片、剪刀、砂纸、玻璃杯 |
| 实验步骤 | 1、用三个小玻璃杯各取适量白醋,用砂纸把三种金属打磨光亮,再用剪刀剪三种金属少量分别加入白醋中; 2、用剪过剩下的铝片放入放铁的杯子中,充分振荡; |
| 实验现象 | 1、放铝和铁的杯子中产生气泡,放铜的杯子中没有,且放铁的杯子中溶液颜色变为浅绿色; 2、铝片表面出现灰黑色固体,且溶液颜色由浅绿色变为无色; |
| 实验结论 | 1、铝和铁的活动性都比铜强; 2、铝的活动性大于铁;所以:铝>铁>铜 |
| 注意事项 | 观察颜色的变化要仔细呦! |
(4)
| 序号 | 4 |
| 实验名称 | 自制碳酸饮料 |
| 家庭用到的实验器材及药品 | 凉开水250克、柠檬汁1.5克、白糖8克、小苏打(NaHCO3)1.5克、500ml饮料瓶、适量果汁 |
| 实验步骤 | 1、在约500mL的饮料瓶中加入约8克白糖和适量果汁;2、加入约1.5g小苏打;3、注入凉开水;4、再加入约1.5g柠檬汁;5、立即旋紧瓶盖,摇匀,放入冰箱。半小时后,你就可以喝到清凉甘甜的汽水了。 |
| 实验现象 | 1、产生气泡; 2、气泡消失。 |
| 实验结论 | 1、碳酸氢钠与柠檬酸反应,生成二氧化碳; 2、二氧化碳与水反应生成碳酸,即碳酸饮料。 |
| 注意事项 | 原料的量,根据口味不同,适当可以调整呦! |
(5)
| 序号 | 5 |
| 实验名称 | “切断”的烛焰 |
| 家庭用到的实验器材及药品 | 粗铜丝(多股)蜡烛火柴 |
| 实验步骤 | 1、用粗铜丝绕成一个内径比蜡烛直径稍小点的线圈,圈与圈之间需有一定的空隙;2、点燃蜡烛,把铜丝制成的线圈放在火焰的中间。 |
| 实验现象 | 铜圈上方的火焰被“切断”,下方的火焰正常燃烧。 |
| 实验结论 | 铜具有良好的导热能力。当铜丝罩在蜡烛火焰的中间时,上方火焰的热量被铜丝带走,使蜡烛火焰上方的温度低于其着火点,上方火焰就熄灭了。 |
| 注意事项 | 小心烫手呦! |
(6)
| 序号 | 6 |
| 实验名称 | 瓶“吃”鸡蛋 |
| 家庭用到的实验器材及药品 | 熟鸡蛋白醋广口瓶蘸有酒精的棉球火柴镊子 |
| 实验步骤 | 1、将熟鸡蛋浸在白醋中,待鸡蛋壳变软后,将蛋取出;2、找一个瓶口略比鸡蛋小的广口瓶,往广口瓶中投入一燃着的酒精棉球,迅速将鸡蛋的小头对准瓶口。 |
| 实验现象 | 1、鸡蛋壳表面产生许多气泡; 2、鸡蛋很快被吸入瓶中。 |
| 实验结论 | 酒精燃烧消耗瓶中氧气,瓶中压强低于外界大气压,外界气压把鸡蛋压入瓶中。 |
| 注意事项 | 注意鸡蛋放入瓶口的时机;瓶中的鸡蛋可能会变硬。 |
(7)
| 序号 | 7 |
| 实验名称 | 水变“汽水” |
| 家庭用到的实验器材及药品 | 白醋(CH3COOH)碱面(Na2CO3)自来水玻璃棒细玻璃杯 |
| 实验步骤 | 1、取适量碱面溶于水,用玻璃棒搅拌,形成澄清液体;2、倒入白醋。 |
| 实验现象 | 可看到有大量气泡从液体中涌出,犹如“汽水”一般。 |
| 实验结论 | 碳酸钠与醋酸反应生成二氧化碳气体。 |
| 注意事项 | 白醋与碱面的量,可以自己控制呦! |
(8)
| 序号 | 8 |
| 实验名称 | 水变“牛奶” |
| 家庭用到的实验器材及药品 | 碱面生石灰自来水玻璃棒细玻璃杯 |
| 实验步骤 | 1、取适量碱面和生石灰,分别溶于水,用玻璃棒搅拌,取上层清液于两细玻璃杯中;2、把一细玻璃杯中的液体倒入另一细玻璃杯中。 |
| 实验现象 | 产生像“牛奶”一样的白色浑浊。 |
| 实验结论 | 1、生石灰与水反应生成氢氧化钙; 2、碳酸钠与氢氧化钙反应生成碳酸钙,碳酸钙难溶于水。 |
| 注意事项 | 因为石灰有腐蚀性,在配制石灰水时,注意安全,防止溅到皮肤、衣服,特别是眼睛。 |
(9)
| 序号 | 9 |
| 实验名称 | 硬、软水检验 |
| 家庭用到的实验器材及药品 | 洗洁精家用饮水玻璃杯筷子 |
| 实验步骤 | 1、用玻璃杯取小半杯家用饮水; 2、挤倒5-6滴洗洁精,用筷子搅拌; |
| 实验现象 | 1、若产生大量泡沫,且无垢状物; 2、若几乎没有泡沫,且产生许多垢状物; |
| 实验结论 | 1、家用饮水是软水; 2、家用饮水是硬水。 |
| 注意事项 | 洗洁精也可用肥皂水代替。 |
(10)
| 序号 | 10 |
| 实验名称 | 瓶“吐”鸡蛋 |
| 家庭用到的实验器材及药品 | 吸滤瓶(可到化学仪器商店购买)去壳熟鸡蛋注射器胶皮管纯碱(Na2CO3)白醋 |
| 实验步骤 | 1、把去壳熟鸡蛋放入口径比鸡蛋略小的吸滤瓶中,让鸡蛋堵住瓶口,保持瓶口向下;2、用注射器从导管注入饱和Na2CO3溶液;3、再用注射器注入白醋; |
| 实验现象 | 1、会产生许多气泡; 2、鸡蛋被吐了出来。 |
| 实验结论 | Na2CO3溶液与醋酸反应产生二氧化碳,使瓶中的压强增大,把鸡蛋压出来。 |
| 注意事项 | Na2CO3溶液和白醋的量尽可能多一些。 |
(11)
| 序号 | 11 |
| 实验名称 | 鸡蛋“煮熟”之谜 |
| 家庭用到的实验器材及药品 | 鸡蛋玻璃杯生石灰(CaO)自来水 |
| 实验步骤 | 在玻璃杯里放入适量生石灰粉末,鸡蛋放在上面,然后倒水浸没鸡蛋。 |
| 实验现象 | 产生大量白雾;过一会儿,鸡蛋被煮熟。 |
| 实验结论 | CaO与水反应生成熟石灰Ca(OH)2,同时放出大量的热量。 |
| 注意事项 | 1Kg氧化钙和水反应,产生的热量可以烧开近两热水瓶的水。 |
(12)
| 序号 | 12 |
| 实验名称 | 自制喷泉 |
| 家庭用到的实验器材及药品 | 稀硫酸锌片红墨水广口瓶(两个)导管尖嘴玻璃管胶皮管长颈漏斗橡皮塞 |
| 实验步骤 | 取两只广口瓶,按图示装配好,右瓶的水中滴几滴红墨水,左瓶中放入锌片,从长颈漏斗中注入稀硫酸。 |
| 实验现象 | 左瓶中产生气泡;尖嘴玻璃管处像喷泉一样喷出红色的水。 |
| 实验结论 | 稀硫酸与锌反应生成氢气,氢气难溶于水,右瓶中压强增大,把水压进玻璃管中,形成喷泉。 |
| 注意事项 | 装置不能漏气;长颈漏斗下端要浸没在液体以下。 |
(13)
| 序号 | 13 |
| 实验名称 | 铁树“开花” |
| 家庭用到的实验器材及药品 | 铁丝果导片浓氨水棉球 |
| 实验步骤 | 1、把果导片捣碎,加入足量水,搅拌,静置,取上层液体得酚酞试液;2、把铁丝编成树状,把沾有酚酞的棉球挂在铁树枝上;3、把铁树放在敞口的盛有浓氨水的瓶口上方。 |
| 实验现象 | 一会儿,可看到棉球变成了红色,整个铁树就像开花了一样。 |
| 实验结论 | 浓氨水有强烈的挥发性,挥发出的氨气使无色酚酞试液变红。 |
| 注意事项 | 浓氨水挥发出的氨气有毒,尽量带上口罩。 |
(14)
| 序号 | 14 |
| 实验名称 | 变“瘪”的瓶子 |
| 家庭用到的实验器材及药品 | 雪碧饮料塑料瓶水带导管的单孔橡皮塞 |
| 实验步骤 | 1、在塑料瓶里放入约1/3的水;2、用带导管的单孔橡皮塞塞住雪碧瓶口,导管另一端放进塑料瓶里;3、一段时间后,盖紧瓶盖,用力振荡塑料瓶。 |
| 实验现象 | 塑料瓶变瘪了。 |
| 实验结论 | 雪碧饮料里产生大量气泡,那是二氧化碳,与水反应后,塑料瓶内的压强减小,外界气压把塑料瓶子压瘪了。 |
| 注意事项 | 向塑料瓶里通气体的时间要长一些,必要时可轻轻摇晃雪碧瓶。 |
(15)
| 序号 | 15 |
| 实验名称 | 巧除水垢 |
| 家庭用到的实验器材及药品 | 白醋炊壶(内有大量的“茶碱”)清水 |
| 实验步骤 | 取一内有大量“茶碱”的炊壶,向里倒入约50—100毫升白醋,左右旋转炊壶,让白醋接触“茶碱”,过一会,用较多的清水冲洗。 |
| 实验现象 | 1、“茶碱”处产生许多气泡; 2、“茶碱”逐渐脱落。 |
| 实验结论 | “茶碱”不溶于水,但能与醋酸反应,生成二氧化碳气体和能溶于水的物质,被清水冲洗掉。 |
| 注意事项 | 用白醋浸泡的时间不宜太长,防止与铝或铁反应损坏炊壶。 |
定义:
氧气,空气主要组分之一,比空气重,标准状况(0℃和大气压强101325帕)下密度为1.429克/升。无色、无臭、无味。在水中溶解度很小。压强为101kPa时,氧气在约-183摄氏度时变为淡蓝色液体,在约-218摄氏度时变成雪花状的淡蓝色固体。
氧气的性质:
1.氧气的物理性质:
(1)无色无味,标况下,氧气的密度为1.429g/L,密度比空气大,难溶于水,1L水中只能溶解约30ml的氧气。
(2)三态变化:氧气(无色气体) 液氮(淡蓝色液体)
液氮(淡蓝色液体)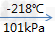 固态氮(淡蓝色雪花状)
固态氮(淡蓝色雪花状)
(3)工业产生的氧气,一般加压贮存在蓝色的钢瓶中。
2.氧气的化学性质:
(1)化学性质较活泼,在一定条件下,可以和多种物质发生化学反应,同时放出热量;具有助燃性和氧化性,在化学反应中提供氧,是一种常用的氧化剂。
(2)助燃性,氧化性
①与金属的反应:
2Mg+O2 2MgO
2MgO
3Fe+2O2 Fe3O4
Fe3O4
②与非金属的反应:
C+O2 CO2(O2充分)
CO2(O2充分)
2C+O2 2CO(O2不充分)
2CO(O2不充分)
③与化合物的反应:
2CO+O2 2CO2
2CO2
CH4+2O2 CO2+2H2O
CO2+2H2O
C2H5OH+3O2 2CO2+3H2O
2CO2+3H2O
易错点:
(1)误认为氧气具有可燃性,可以做燃料
氧气可以帮助可燃物燃烧,具有助燃性,它本身不能燃烧,不能做可燃物。
(2)误认为氧气的化学性质非常活泼,能与所有物质发生反应
氧气是一种化学性质非常活泼的气体,在一定条件下能与许多物质发生化学反应,但不是与所有物质都能发生化学反应。
(3)误认为燃烧都需要氧气
燃烧有广义和狭义之分,通常所说的燃烧是指可燃物与氧气发生的一种发光,放热的剧烈的氧化反应。燃烧的条件之一是需要氧气。但有一些燃烧不需要氧气,如镁在二氧化碳中也能燃烧。
(4)误认为物质与氧气的反应叫氧化反应
氧化反应是物质与氧发生的反应,其中包括物质与氧气中的氧元素发生的反应,也包括物质与其他含氧物质中的氧元素发生的反应。如氢气与氧气反应生成水是氧化反应,氢气与氧化铜反应生成铜和水也是氧化反应。
(5)误认为氧气与液氧性质不行
物质的性质包括物理性质和化学性质,氧气与液氧物理性质不同,但化学性质是相同的,因为它们二者的分子构成相同,都是由氧分子构成的。
(6)误认为含氧的物质都能制取氧气。
制取氧气需要含氧的物质,但不是所有的含氧物质都能用来制取氧气。
氧气,空气主要组分之一,比空气重,标准状况(0℃和大气压强101325帕)下密度为1.429克/升。无色、无臭、无味。在水中溶解度很小。压强为101kPa时,氧气在约-183摄氏度时变为淡蓝色液体,在约-218摄氏度时变成雪花状的淡蓝色固体。
氧气的性质:
1.氧气的物理性质:
(1)无色无味,标况下,氧气的密度为1.429g/L,密度比空气大,难溶于水,1L水中只能溶解约30ml的氧气。
(2)三态变化:氧气(无色气体)
 液氮(淡蓝色液体)
液氮(淡蓝色液体) 固态氮(淡蓝色雪花状)
固态氮(淡蓝色雪花状)(3)工业产生的氧气,一般加压贮存在蓝色的钢瓶中。
2.氧气的化学性质:
(1)化学性质较活泼,在一定条件下,可以和多种物质发生化学反应,同时放出热量;具有助燃性和氧化性,在化学反应中提供氧,是一种常用的氧化剂。
(2)助燃性,氧化性
①与金属的反应:
2Mg+O2
 2MgO
2MgO3Fe+2O2
 Fe3O4
Fe3O4②与非金属的反应:
C+O2
 CO2(O2充分)
CO2(O2充分)2C+O2
 2CO(O2不充分)
2CO(O2不充分)③与化合物的反应:
2CO+O2
 2CO2
2CO2CH4+2O2
 CO2+2H2O
CO2+2H2OC2H5OH+3O2
 2CO2+3H2O
2CO2+3H2O易错点:
(1)误认为氧气具有可燃性,可以做燃料
氧气可以帮助可燃物燃烧,具有助燃性,它本身不能燃烧,不能做可燃物。
(2)误认为氧气的化学性质非常活泼,能与所有物质发生反应
氧气是一种化学性质非常活泼的气体,在一定条件下能与许多物质发生化学反应,但不是与所有物质都能发生化学反应。
(3)误认为燃烧都需要氧气
燃烧有广义和狭义之分,通常所说的燃烧是指可燃物与氧气发生的一种发光,放热的剧烈的氧化反应。燃烧的条件之一是需要氧气。但有一些燃烧不需要氧气,如镁在二氧化碳中也能燃烧。
(4)误认为物质与氧气的反应叫氧化反应
氧化反应是物质与氧发生的反应,其中包括物质与氧气中的氧元素发生的反应,也包括物质与其他含氧物质中的氧元素发生的反应。如氢气与氧气反应生成水是氧化反应,氢气与氧化铜反应生成铜和水也是氧化反应。
(5)误认为氧气与液氧性质不行
物质的性质包括物理性质和化学性质,氧气与液氧物理性质不同,但化学性质是相同的,因为它们二者的分子构成相同,都是由氧分子构成的。
(6)误认为含氧的物质都能制取氧气。
制取氧气需要含氧的物质,但不是所有的含氧物质都能用来制取氧气。
氢气:
氢气(Hydrogen)是世界上已知的最轻的气体。它的密度非常小,只有空气的1/14,即在标准大气压,0℃下,氢气的密度为0.0899g/L。所以氢气可作为飞艇的填充气体(由于氢气具有可燃性,安全性不高,飞艇现多用氦气填充)。氢气主要用作还原剂。
氢气的性质:
1、氢气的物理性质
在通常状况下,氢气是一种无色、无味的气体。氢气难溶于水。氢气是所有气体中密度最小的一种气体。标准状况下,氢气的密度是0.0899克/升。在101kPa下,温度为-252.87℃时,氢气可转变为无色的液体;-259.1℃时变为雪状固体。
2、氢气的化学性质(可燃性)
①纯净的氢气在空气中可以安静的燃烧,产生淡蓝色火焰,罩在火馅上方的干冷烧杯壁上有水雾出现,接触烧怀的手感到发烫,说明该反应生成水,并放出大量热。
反应的化学方程式为2H2+O2
 2H2O
2H2O ②不纯的氧气(混有空气或氧气)点燃时极易爆炸,因此使用氢气时一定要注意安全,点燃前一定要先检验氢气的纯度
氢气和氧气的比较:
| 类别 | 氢气 | 氧气 |
| 物理性质 | 无色、无味、气体 比空气小,氢气是最轻的气体 难溶于水 |
无色、无味、气体 比空气略大 不易溶于水 |
| 检验 | 点然时,发出淡蓝色火焰,罩在火焰上方的干冷烧杯内壁上出现水珠 | 用带火星的木条检验,木条复燃 |
| 化学性质 | ①常温下性质稳定 ②可燃性:在点燃条件下燃烧,但不能支持燃烧 |
①化学性质比较活泼 ②助燃性:支持燃烧,但其本身无可燃性 ③氧化性:在氧化反应中提供氧 |
概述:
二氧化硫(化学式:SO2)是最常见的硫氧化物。无色气体,有强烈刺激性气味。大气主要污染物之一。火山爆发时会喷出该气体,在许多工业过程中也会产生二氧化硫。由于煤和石油通常都含有硫化合物,因此燃烧时会生成二氧化硫。当二氧化硫溶于水中,会形成亚硫酸(酸雨的主要成分)。
物理性质:
无色,常温下为无色有刺激性气味的有毒气体,密度比空气大,易液化,易溶于水(约为1:40)密度2.551g/L。(气体,20摄氏度下) 熔点:-72.4℃(200.75K) 沸点:-10℃(263K)
化学性质:
(1)SO2+H2O==H2SO3(亚硫酸是酸雨的主要成分)
(2)漂白性:使品红溶液褪色
二氧化硫的危险:
1. 健康危害
易被湿润的粘膜表面吸收生成亚硫酸、硫酸。对眼及呼吸道粘膜有强烈的刺激作用。大量吸入可引起肺水肿、喉水肿、声带痉挛而致窒息。
2. 急性中毒
轻度中毒时,发生流泪、畏光、咳嗽,咽、喉灼痛等;严重中毒可在数小时内发生肺水肿;极高浓度吸入可引起反射性声门痉挛而致窒息。皮肤或眼接触发生炎症或灼伤。慢性影响:长期低浓度接触,可有头痛、头昏、乏力等全身症状以及慢性鼻炎、咽喉炎、支气管炎、嗅觉及味觉减退等。少数工人有牙齿酸蚀症。
3. 环境危害
对大气可造成严重污染。容易被空气中的粉尘催化氧化,进而形成硫酸型酸雨。(化学式2SO2+2H2O+O2=2H2SO4)
4. 燃爆危险
该品不自燃,有毒,具强刺激性。
急救措施:
1. 皮肤接触 立即脱去污染的衣着,用大量流动清水冲洗;就医。
2. 眼睛接触 提起眼睑,用流动清水或生理盐水冲洗;就医。
3. 吸入 迅速脱离现场至空气新鲜处。保持呼吸道通畅。如呼吸困难,给输氧。如呼吸停止,立即进行人工呼吸;就医。
4. 食入 用水漱口,饮牛奶或生蛋清;就医。
三氧化硫:
先将硫黄或黄铁矿在空气中燃烧或焙烧,以得到二氧化硫气体。将二氧化硫氧化为三氧化硫是生产硫酸的关键,其反应为: 2SO2+O2→2SO3(可逆)
定义:
化学上是指在溶液中电离时阳离子完全是氢离子的化合物。
酸的通性:
(1)跟指示剂反应 紫色石蕊试液遇酸变红色无色酚酞试液遇酸不变色
(2)跟活泼金属(金属活动性顺序表中比氢强的金属)发生置换反应酸+金属=盐+氢气 例:2HCl+Fe=FeCl2+H2↑
(3)跟碱性氧化物反应酸+碱性氧化物→盐+水 3H2SO4+Fe2O3=Fe2(SO4)3+3H2O
(4)跟某些盐反应酸+盐→新酸+新盐 H2SO4+BaCl2=2HCl+BaSO4↓
(5)跟可溶性碱发生中和反应酸+碱→盐+水 2HCl+Ba(OH)2=BaCl2+2H2O
常见酸的性质:
(1)盐酸是氯化氢的水溶液,是一种混合物。纯净的盐酸是无色的液体,有刺激性气味。
工业浓盐酸因含有杂质(Fe3+)带有黄色。浓盐酸具有挥发性,打开浓盐酸的瓶盖在瓶口
立即产生白色酸雾。这是因为从浓盐酸中挥发出来的氯化氢气体跟空气中水蒸汽接触,形
成盐酸小液滴分散在空气中形成酸雾。
(2)硫酸是一种含氧酸,对应的酸酐是SO3。纯净的硫酸是没有颜色、粘稠、油状的液体,不易挥发。稀H2SO4具有酸的通性。浓硫酸除去具有酸的通性外,还具有三大特性:
①吸水性: 浓H2SO4吸收水形成水合硫酸分子(H2SO4·nH2O),并放出大量热,所以浓硫酸通常用作干燥剂。
②脱水剂: 浓硫酸可将有机化合物中的氢原子和氧原子按水分子的构成(H:O=2:1)夺取而使有机物脱水碳化。纸、木柴、衣服等遇浓硫酸变黑,这就是因为浓硫酸的脱水性使其碳化的缘故。
③强氧化性:
在浓硫酸溶液中大量存在的是H2SO4分子而不是H+,H2SO4分子具强氧化性。
浓硫酸可使金属活动性顺序表氢后面的一些金属溶解,可将C、S等非金属单质氧化,而浓硫酸本身还原成SO2。但是,冷的浓硫酸不能与较活泼的金属Fe和Al反应。原因是浓硫酸可以使Fe和Al的表面形成一层致密的氧化物薄膜,阻止了里面的金属与浓硫酸继续反应,这种现象在化学上叫钝化。由于浓硫酸有脱水性和强氧化性,我们往蔗糖上滴加浓硫酸,会看到蔗糖变黑并且体积膨胀。又由于浓硫酸有吸水性,浓盐酸有挥发性,所以,往浓盐酸中滴加浓硫酸会产生大量酸雾,可用此法制得氯化氢气体。
(3)硝酸也是一种含氧酸,对应的酸酐是N2O5,而不是NO2。
纯净的硝酸是无色的液体,具有刺激性气味,能挥发。打开浓硝酸的瓶盖在瓶口会产生白色酸雾。浓硝酸通常带黄色,而且硝酸越浓,颜色越深。这是因为硝酸具有不稳定性,光照或受热时分解产生红棕色的NO2气体,NO2又溶于硝酸溶液中而呈黄色。所以,实验室保存硝酸时要用棕色(避光)玻璃试剂瓶,贮存在黑暗低温的地方。硝酸又有很强的腐蚀性,保存硝酸的试剂瓶不能用橡胶塞,只能用玻璃塞。
硝酸除具有酸的通性外,不管是稀硝酸还是浓硝酸都具有强氧化性。硝酸能溶解除金和铂以外的所有金属。金属与硝酸反应时,金属被氧化成高价硝酸盐,浓硝酸还原成NO2,稀硝酸还原成NO。但是,不管是稀硝酸还是浓硝酸,与金属反应时都没有氢气产生。较活泼的金属铁和铝可在冷浓硝酸中钝化,冷浓硝酸同样可用铝槽车和铁罐车运输和贮存。硝酸不仅能氧化金属,也可氧化C、S、P等非金属。
浓H2SO4为什么能做干燥剂:
因为浓H2SO4有强烈的吸水性,当它遇到水分子后,能强烈地和水分子结合,生成一系列水合物。这些水合物很稳定,不易分解,所以浓H2SO4是一种很好的干燥剂,能吸收多种气体中的水蒸气,实验室常用来干燥酸性或中性气体。如:CO2,SO2,H2,O2可用浓H2SO4干燥,但碱性气体如:NH3不能用浓H2SO4来干燥。
为什么浓H2SO4能用铁槽来运输:
当铁在常温下和浓H2SO4接触时,它的表面能生成一层致密的氧化膜,这层氧化膜能阻止浓H2SO4;对铁的进一步腐蚀,这种现象叫钝化。
活泼金属能置换出浓H2SO4中的氢吗?
稀H2SO4具有酸的通性,活泼金属能置换出酸中的氢。而浓H2SO4和稀H2SO4的性质不同,活泼金属与浓H2SO4反应时,不能生成氢气,只能生成水和其他物质,因为它具有强氧化性。
敞口放置的浓硫酸.浓盐酸.浓硝酸的变化:
胃酸:
在人的胃液里,HCl的溶质质最分数为0.45%— 0.6%,胃酸是由胃底腺的壁细胞分泌的。它具有以下功能:
(1)促进胃蛋白酶的催化作用,使蛋白质在人体内容易被消化,吸收;(2)使二糖类物质如蔗糖、麦芽糖水解;(3)杀菌。
酸的分类和命名
1.酸根据组成中是否含氧元素可以分为含氧酸和无氧酸。如:盐酸(HCl)属于无氧酸,硫酸(H2SO4)、硝酸(HNO3)属于含氧酸。
2.酸还可以根据每个酸分子电离出的H+个数,分为一元酸、二元酸、多元酸。如:每分子盐酸、硝酸溶于水时能电离出一个H+,属于一元酸;每分子硫酸溶于水时能电离出两个H+,属于二元酸。
3.无氧酸一般从前往后读作“氢某酸”。如:HCl读作氢氯酸(盐酸是其俗名),H2S读作氢硫酸。
4.含氧酸命名时一般去掉氢、氧两种元素,读作 “某”酸。如:H2SO4命名时去掉氢、氧两种元素,读作硫酸,H3PO4读作磷酸。若同一种元素有可变价态,一般低价叫“亚某酸”。如:H2SO3读作亚硫酸,HNO2读作亚硝酸。
化学上是指在溶液中电离时阳离子完全是氢离子的化合物。
酸的通性:
(1)跟指示剂反应 紫色石蕊试液遇酸变红色无色酚酞试液遇酸不变色
(2)跟活泼金属(金属活动性顺序表中比氢强的金属)发生置换反应酸+金属=盐+氢气 例:2HCl+Fe=FeCl2+H2↑
(3)跟碱性氧化物反应酸+碱性氧化物→盐+水 3H2SO4+Fe2O3=Fe2(SO4)3+3H2O
(4)跟某些盐反应酸+盐→新酸+新盐 H2SO4+BaCl2=2HCl+BaSO4↓
(5)跟可溶性碱发生中和反应酸+碱→盐+水 2HCl+Ba(OH)2=BaCl2+2H2O
常见酸的性质:
(1)盐酸是氯化氢的水溶液,是一种混合物。纯净的盐酸是无色的液体,有刺激性气味。
工业浓盐酸因含有杂质(Fe3+)带有黄色。浓盐酸具有挥发性,打开浓盐酸的瓶盖在瓶口
立即产生白色酸雾。这是因为从浓盐酸中挥发出来的氯化氢气体跟空气中水蒸汽接触,形
成盐酸小液滴分散在空气中形成酸雾。
(2)硫酸是一种含氧酸,对应的酸酐是SO3。纯净的硫酸是没有颜色、粘稠、油状的液体,不易挥发。稀H2SO4具有酸的通性。浓硫酸除去具有酸的通性外,还具有三大特性:
①吸水性: 浓H2SO4吸收水形成水合硫酸分子(H2SO4·nH2O),并放出大量热,所以浓硫酸通常用作干燥剂。
②脱水剂: 浓硫酸可将有机化合物中的氢原子和氧原子按水分子的构成(H:O=2:1)夺取而使有机物脱水碳化。纸、木柴、衣服等遇浓硫酸变黑,这就是因为浓硫酸的脱水性使其碳化的缘故。
③强氧化性:
在浓硫酸溶液中大量存在的是H2SO4分子而不是H+,H2SO4分子具强氧化性。
浓硫酸可使金属活动性顺序表氢后面的一些金属溶解,可将C、S等非金属单质氧化,而浓硫酸本身还原成SO2。但是,冷的浓硫酸不能与较活泼的金属Fe和Al反应。原因是浓硫酸可以使Fe和Al的表面形成一层致密的氧化物薄膜,阻止了里面的金属与浓硫酸继续反应,这种现象在化学上叫钝化。由于浓硫酸有脱水性和强氧化性,我们往蔗糖上滴加浓硫酸,会看到蔗糖变黑并且体积膨胀。又由于浓硫酸有吸水性,浓盐酸有挥发性,所以,往浓盐酸中滴加浓硫酸会产生大量酸雾,可用此法制得氯化氢气体。
(3)硝酸也是一种含氧酸,对应的酸酐是N2O5,而不是NO2。
纯净的硝酸是无色的液体,具有刺激性气味,能挥发。打开浓硝酸的瓶盖在瓶口会产生白色酸雾。浓硝酸通常带黄色,而且硝酸越浓,颜色越深。这是因为硝酸具有不稳定性,光照或受热时分解产生红棕色的NO2气体,NO2又溶于硝酸溶液中而呈黄色。所以,实验室保存硝酸时要用棕色(避光)玻璃试剂瓶,贮存在黑暗低温的地方。硝酸又有很强的腐蚀性,保存硝酸的试剂瓶不能用橡胶塞,只能用玻璃塞。
硝酸除具有酸的通性外,不管是稀硝酸还是浓硝酸都具有强氧化性。硝酸能溶解除金和铂以外的所有金属。金属与硝酸反应时,金属被氧化成高价硝酸盐,浓硝酸还原成NO2,稀硝酸还原成NO。但是,不管是稀硝酸还是浓硝酸,与金属反应时都没有氢气产生。较活泼的金属铁和铝可在冷浓硝酸中钝化,冷浓硝酸同样可用铝槽车和铁罐车运输和贮存。硝酸不仅能氧化金属,也可氧化C、S、P等非金属。
浓H2SO4为什么能做干燥剂:
因为浓H2SO4有强烈的吸水性,当它遇到水分子后,能强烈地和水分子结合,生成一系列水合物。这些水合物很稳定,不易分解,所以浓H2SO4是一种很好的干燥剂,能吸收多种气体中的水蒸气,实验室常用来干燥酸性或中性气体。如:CO2,SO2,H2,O2可用浓H2SO4干燥,但碱性气体如:NH3不能用浓H2SO4来干燥。
为什么浓H2SO4能用铁槽来运输:
当铁在常温下和浓H2SO4接触时,它的表面能生成一层致密的氧化膜,这层氧化膜能阻止浓H2SO4;对铁的进一步腐蚀,这种现象叫钝化。
活泼金属能置换出浓H2SO4中的氢吗?
稀H2SO4具有酸的通性,活泼金属能置换出酸中的氢。而浓H2SO4和稀H2SO4的性质不同,活泼金属与浓H2SO4反应时,不能生成氢气,只能生成水和其他物质,因为它具有强氧化性。
敞口放置的浓硫酸.浓盐酸.浓硝酸的变化:
| 酸的名称 | |||||
| 浓盐酸 | 挥发性 | 变小 | 不变 | 变小 | 变小 |
| 浓硫酸 | 挥发性 | 变小 | 不变 | 变小 | 变小 |
| 浓硝酸 | 吸水性 | 不变 | 变大 | 变大 | 变小 |
胃酸:
在人的胃液里,HCl的溶质质最分数为0.45%— 0.6%,胃酸是由胃底腺的壁细胞分泌的。它具有以下功能:
(1)促进胃蛋白酶的催化作用,使蛋白质在人体内容易被消化,吸收;(2)使二糖类物质如蔗糖、麦芽糖水解;(3)杀菌。
酸的分类和命名
1.酸根据组成中是否含氧元素可以分为含氧酸和无氧酸。如:盐酸(HCl)属于无氧酸,硫酸(H2SO4)、硝酸(HNO3)属于含氧酸。
2.酸还可以根据每个酸分子电离出的H+个数,分为一元酸、二元酸、多元酸。如:每分子盐酸、硝酸溶于水时能电离出一个H+,属于一元酸;每分子硫酸溶于水时能电离出两个H+,属于二元酸。
3.无氧酸一般从前往后读作“氢某酸”。如:HCl读作氢氯酸(盐酸是其俗名),H2S读作氢硫酸。
4.含氧酸命名时一般去掉氢、氧两种元素,读作 “某”酸。如:H2SO4命名时去掉氢、氧两种元素,读作硫酸,H3PO4读作磷酸。若同一种元素有可变价态,一般低价叫“亚某酸”。如:H2SO3读作亚硫酸,HNO2读作亚硝酸。
发现相似题
与“用下图装置做趣味实验:在用胶塞塞紧的烧瓶里充满某种气体(X...”考查相似的试题有:
- 如下图所示进行实验,同时将针筒内全部液体迅速注入容器中,实验内容如下表所示。(1)实验开始前红墨水左右两端液面保持相平...
- 图为两个实验装置中均盛有少量的水,请说出它们的不同作用.
- 根据下图实验示意图回答问题:(1)写出标有①的仪器的名称______;(2)由实验B得出水是由氢元素和______ 元素组成的.(3)...
- 根据所给信息,在横线上填上相应的化学式:(1)燃气热水器在燃烧不充分时产生的有毒气体 ;(2)空气中含量最高、常用做保护...
- 下图是我市某校学生设计的“硫燃烧现象及酸雨危害模拟实验”装置图。实验是操作步骤为:①连接仪器,装好药品;②将玻璃棒下端在...
- 下列生活中变化属于物理变化的是 ( ) A.葡萄酿成酒B.木炭燃烧变成灰烬C.实验室制取氧气D.分离液态空气制氧气
- 瑶瑶同学在家中自制“汽水”,她在约500mL的饮料瓶中加入2匙白糖、1.5g小苏打(碳酸氢钠)和适量果汁,注入凉开水,再加入1.5g柠...
- 有关溶液的叙述正确的是( )A.溶液一定是无色透明的B.溶液一定能导电C.均一、稳定的液体一定是溶液D.溶液不一定只由一种...
- 下列各组物质在溶液中,不能发生复分解反应的是( )A.盐酸和氢氧化钠B.碳酸钠和稀硫酸C.氯化钠和氢氧化钾D.硝酸银和氯化钡
- 下列试剂中不能鉴别稀硫酸和氢氧化钠溶液两种溶液的是( )A.氯化钡溶液B.氯化钾溶液C.硫酸铜溶液D.碳酸钠溶液