本试题 “下列判断错误的是[ ]A.沸点:NH3>PH3>AsH3B.熔点:Si3N4>NaCl>SiI4C.酸性:HClO4>H2SO4>H3PO4D.碱性:NaOH>Mg(OH)2>Al(OH)3” 主要考查您对原子晶体
离子晶体
分子晶体
元素周期律
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 原子晶体
- 离子晶体
- 分子晶体
- 元素周期律
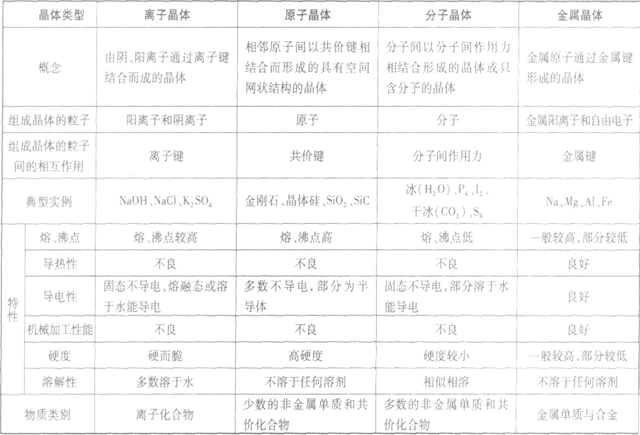
相邻原子间以共价键相结合而形成空间网状结构的晶体,熔沸点高,导热性、延展性不良,导电性差,硬度大。如:金刚石、石英。
晶体的基本类型与性质:
晶体熔、沸点高低的比较规律:
(1)不同类型晶体的熔、沸点高低规律:一般,原子晶体>离子晶体>分子晶体。金属晶体的熔、沸点有的很高,如钨、铂等;有的则很低,如汞、铯等。
(2)同种类型晶体,晶体内粒子间的作用力越大,熔、沸点越高。
①分子晶体:分子间作用力越大,物质的熔、沸点越高,反之越低。
a.组成和结构相似的分子,相对分子质量越大,范德华力越大,熔、沸点越高。如沸点:O2>N2、HI>HBI>HCl(含氢键的除外)。
b.相对分子质量相等或相近的分子,极性分子的范德华力大,熔、沸点高。如沸点:CO>N2。
c.含有氢键的分子熔、沸点比较高。如沸点:H2O >H2Te>H2Se>H2S,HF>HCl,NH3>PH3。
d.在烷烃的同分异构体中,一般来说,支链越多,熔、沸点越低。如沸点:正戊烷>异戊烷>新戊烷。芳香烃及其衍生物苯环上的同分异构体熔、沸点大小一般按照“邻位>问位>对位”的顺序。
e.在高级脂肪酸形成的油脂中,油的熔、沸点比脂肪低,烃基部分的不饱和程度越大(碳碳双键越多),熔、沸点越低,如:
(C17H35COO)3C3H5>(C17H33COO)3C3H5
硬脂酸甘油酯 油酸甘油酯
②原子晶体:要比较共价键的强弱。一般来说,原子半径越小,键长越短,键能越大,共价键越牢固,晶体的熔、沸点越高.如熔点:金刚石(C—C)>金刚砂 (Si—C)>晶体硅(Si—Si)>锗(Ge—Ge)。
③离子晶体:要比较离子键的强弱。一般来说,阴、阳离子电荷数越多,离子半径越小,离子键越强,熔、沸点越高,如熔点:MgO>NaCl,KF>KCl>KBr> KI。离子晶体的晶格能越大,其熔、沸点越高。
④金属晶体:要比较金属键的强弱。金属晶体中金属原子的价电子数越多,原子半径越小,金属阳离子与自由电子间的静电作用越强,金属键越强,熔、沸点越高,反之越低,如熔点:Na<Mg<Al。
(3)元素周期表中ⅦA族卤素的单质(分子晶体) 的熔、沸点随原子序数递增而升高;笫IA族碱金属元素的单质(金属晶体)的熔、沸点随原子序数的递增而降低。如熔、沸点:Li>Na>K>Rb>Cs。
注意:上述总结的是一般规律,不能绝对化。在具体比较晶体的熔、沸点高低时,应先弄清晶体的类型,然后根据不同类型晶体进行判断,但应注意具体问题具体分析。如MgO为离子晶体,[大]为离子半径小且离子电荷多,离子键较强,其熔点(2852℃)要高于部分原子晶体,如SiO2(1710℃)。
离子间通过离子间结合而形成的晶体,熔点较高、沸点高,导热性、延展性不良,固态不导电、熔融或溶于水导电,脆而硬,如:NaCl
晶体的基本类型与性质:

晶体类型的判断方法:
1.依据晶体的组成微粒与微粒间作用力来判断
离子晶体的组成微粒是阴、阳离子,微粒间作用力是离子键;原子晶体的组成微粒是原子,微粒间作用力是共价键;分子晶体的组成微粒是分子,微粒间作用力是分子间作刚力;金属晶体的组成微粒是金属阳离子和自南电子,微粒间作用力是金属键。
2.依据物质的分类判断
金属氧化物(如K2O、Na2O等)、强碱(如NaOH、 KOH等)和绝大多数的盐是离子晶体。大多数非金属单质(除金刚石、石墨、品体硅、晶体硼以外)、气态氢化物、非金属氧化物(除SiO2以外)、酸、绝大多数有机物 (除有机盐以外)都是分子晶体。常见的属于原子晶体的单质有金刚石、晶体硅、晶体硼、晶体锗等,常见的属于啄子品体的化合物有碳化硅(SiC)、氮化硅(Si3N4)、氮化硼(BN)、二氧化硅(SiO2)等。金属单质与合金是金属晶体.
3.依据晶体的熔点判断
离子晶体熔点较高,常在几百至一千摄氏度。原子晶体熔点高,常在一千至几千摄氏度。分子晶体熔点低,常在几百摄氏度以下至很低的温度。金属晶体的熔点范围最广,钨的熔点比部分原子晶体还要高,汞的熔点比部分分子晶体还要低。
4.依据导电性判断离子晶体水溶液及熔化时能导电、原子晶体一般为非导体。分子晶体为非导体,但分子晶体中的电解质溶于水,使分子内的化学键断裂形成自由离子也能导电。金属晶体是电的良导体。
5.依据硬度和机械性能判断
离子晶体硬度大(或硬而脆);分子晶体硬度较小;原子晶体硬度大;金属晶体多数硬度大,但也有较小的,具有延展性。
分子之间通过分子间作用力结合形成的晶体,熔沸点低,导热性、延展性不良,导电性差,硬度较小。如:干冰、固态氖。
晶体的基本类型与性质:

晶体结构模型:
| 晶体 | 晶体结构模型 |
| 氯化铯晶体 |  |
| 氯化钠晶体 | 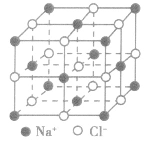 |
| 氟化钙晶体 |  |
| 二氧化碳晶体 | 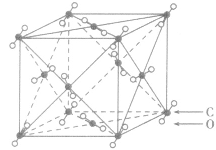 |
| 金刚石晶体 |  |
| SiO2晶体 | 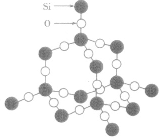 |
| 石墨晶体 (混合晶体) | 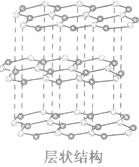 |
晶体中的几个不一定:
(1)由非金属元素构成的晶体不一定为分子品体。如NH4Cl。
(2)具有导电性的晶体不一定是金属晶体。如Si、石墨。
(3)离子晶体不一定只含离子键。如NaOH、 FeS2、Na2O2。
(4)由氢化物构成的晶体不一定是分子晶体。如NaH。
(5)金属与非金属元素构成的晶体不一定是离子晶体。如AlCl3为分子晶体。
(6)原子晶体不一定为绝缘体。如Si。
(7)溶于水能导电的晶体不一定是离子晶体。如HCl。
(8)离子晶体的熔点不一定低于原子晶体。如 MgO的熔点为2852℃,而SiO2的熔点为1710℃。
(9)金属晶体的熔点不一定低于原子晶体。如w 的熔点达34lO℃。
(10)金属晶体的熔点不一定高于分子晶体。如 Hg常温下呈液态,而硫、白磷常温下呈同态.
(11)金属晶体的硬度不一定小于原子晶体。如Cr 的硬度为9,仅次于金刚石。
(12)金属晶体的硬度不一定大于分子晶体。如 Na的硬度只有0.4,可用小刀切割。
(13)晶体巾有阳离子不一定有阴离子。如构成金
定义:
元素的性质随原子序数的递增而呈现周期性变化的规律叫元素周期律。
实质:
元素性质随原子序数递增呈现周期性变化是元素原子的核外电子排布周期性变化的必然结果。
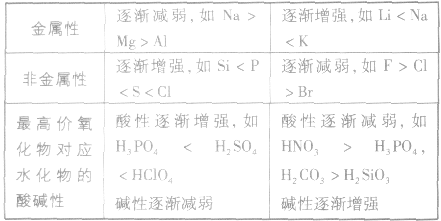
元素周期表中主族元素性质递变规律:

金属性强弱的判断依据:
1.单质跟水或酸反应置换出氢的难易程度(或反应的剧烈程度):反应越容易,说明其金属性越强。
2.最高价氧化物对应水化物的碱性强弱:碱性越强,说明其金属性越强,反之则越弱。
3.金属间的置换反应:依据氧化还原反应的规律,金属甲能从金属乙的盐溶液里置换出乙,说明甲的金属性比乙强。
4.金属活动性顺序按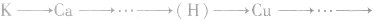 Au顺序,金属性逐渐减弱。
Au顺序,金属性逐渐减弱。
5.元素周期表中,同周期元素从左至右金属性逐渐减弱;同主族元素从上至下金属性逐渐增强。
6.原电池中的正负极:一般情况下,活泼金属作负极。
7.金属阳离子氧化性的强弱:阳离子的氧化性越强.对应金属的金属性就越弱。
非金属性强弱的判断依据:
1.同周期元素,从左到右,随核电荷数的增加,非金属性增强;同主族元素,从上到下,随着陔电荷数的增加,非金属性减弱。
2.最高价氧化物对应水化物的酸性强弱:酸性越强,其元素的非金属性也越强,反之则越弱。
3.气态氢化物的稳定性:稳定性越强,非金属性越强。
4.单质跟氢气化合的难易程度:越易与H2反应,说明其非金属性越强。
5.与盐溶液之间的置换反应:非金属元素甲的单质能从非金属乙的盐溶液中置换出乙,说明甲的非金属性比乙强。如 ,说明溴的非金属性比碘强。
,说明溴的非金属性比碘强。
6.相互化合后的价态:如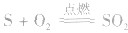 ,说明O 的非金属性强于S。
,说明O 的非金属性强于S。
7.其他:如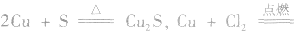 CuCl2,所以C1的非金属性强于S。
CuCl2,所以C1的非金属性强于S。
微粒半径大小的比较方法:
1.同周期元素的微粒
同周期元素的原子或最高价阳离子半径随核电荷数增大而减小(稀有气体元素除外),如半径:Na>Mg >Al,Na+>Mg2+‘>Al3+。
2.同主族元素的微粒
同主族元素的原子或离子半径随核电荷数增大而增大,如半径: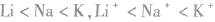
3.电子层结构相同的微粒电子层结构相同(核外电子排布相同)的微粒半径随核电荷数的增加而减小,如半径: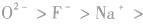
 (上一周期元素形成的阴离子与下一周期元素形成的最高价阳离子有此规律)。
(上一周期元素形成的阴离子与下一周期元素形成的最高价阳离子有此规律)。
4.同种元素形成的微粒同种元素原子形成的微粒半径大小为:阳离子< 中性原子<阴离子;价态越高的微粒半径越小,如半径: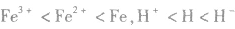 。
。
5.核外电子数和核电荷数都不同的微粒可通过一种参照物进行比较,如比较 的半径大小,可找出与A13+电子数相同,与S同主族的氧元素的阴离子
的半径大小,可找出与A13+电子数相同,与S同主族的氧元素的阴离子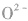 进行比较,半径:
进行比较,半径: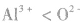 ,且
,且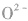
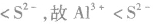
元素周期表中的几项重要规律相等规律:
| 规律 | 内容 |
| 相等规律 | ①周期数:电子层数 ②主族元素原子的最外层电子数=价电子数=主族序数=最高正化合价(F、 0除外) ③最低负价绝对值=8一主族序数(限 ⅣA族~ⅦA族非金属元素) |
| “位、构、性”规律 | |
| 递变规律 | 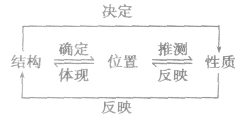 |
| 同周期从左到右,元素的金属性逐渐减弱,非金属性逐渐增强同主族从上到下,元素的金属性逐渐增强,非金属性逐渐减弱 | |
| 奇偶规律 | 在同一主族内,族序数和原子序数、核内质子数、核电荷数、核外电子数、最外层电子数(价电子数)、离子的电荷数、元素的主要正负化合价数等,若一个是偶数,其他的都是偶数,若一个是奇数,其他的都是奇数 |
| 相同电子层结构的规律 | 稀有气体元素的原子与同周期非金属元素的阴离子以及下一周期主族金属元素的阳离子具有相同的电子层结构 |
| 序差规律 | ①同主族相邻元素的原子序数之差与主族序数有关。IA~ⅡA族元素相差原子序数较小的元素所在周期包含的元素种数。ⅢA族~O族元素相差原子序数较大的元素所在周期包含的元素种数。如Na和K的原子序数相差8 (第三周期含8种元素),Cl和Br的原子序数相差18(第四周期含18种元素) ②同周期主族元素(长周期)的原子序数差:两元素分布在过渡元素同侧时,原子序数差=族序数差;两元素分布在过渡元素两侧时,第四或第五周期元素原子序数差=族序数差+10(如第四周期的Ca和Ca相差11),第六、七周期元素原子序数差=族序数差+24(如ⅡA 族的Ba和ⅢA族的Tl相差25) |
| 对角线相似规律 | 周期表中位于对角线位置的元素性质相似,尤以“和Mg、Be和Al最为典型 |
与“下列判断错误的是[ ]A.沸点:NH3>PH3>AsH3B.熔点:Si3N4>Na...”考查相似的试题有:
- 下列说法正确的是( )A.金刚石晶体中,碳原子数与C—C键数之比为1:2B.720g C60晶体含有NA个如图中晶胞单元C.离子晶体中每...
- 干冰和二氧化硅晶体同属ⅣA族元素的最高价氧化物,它们的熔点差别很大的原因是[ ]A.二氧化硅的相对分子质量大于二氧化碳的相对...
- 下列说法正确的是[ ]A.原子晶体中的相邻原子都以共价键相结合B.金属晶体的熔点都比分子晶体的熔点高C.干冰升华时,分子内...
- 下列比较中错误的是[ ]A.沸点:CH4> GeH4> SiH4B.溶解性:NH3> SO2> Cl2C.结合质子的能力:CO32-> C6H5O-> HCO3-D.分散系...
- 下表是周期表中的一部分,根据A~I在周期表中的位置,用元素符号或化学式回答下列问题:ⅠAⅡAⅢAⅣAⅤAⅥAⅦA01A 2 DE G 3B CJ
- 工业上常利用液晶显示屏生产过程中产生的废玻璃粉末为原料回收金属铈(Ce),金属铈是一种重要的稀土元素,原子序数为58,它...
- 下列分子中所有原子都满足最外层为8个电子结构的是A.BF3B.CCl4C.H2OD.PCl5
- A.液态氟化氢中存在氢键,所以其分子比氯化氢更稳定B.阴离子的核外电子排布一定与上一周期稀有气体原子核外排布相同C.甲烷...
- 元素X的原子核外第三层上有3个电子,元素Y的负二价离子核外有10个电子,则这两种元素形成化合物的化学式为( )A.XY2B.X2Y...
- 下列各分子中,所有原子都满足最外层为8电子结构的是()A.H2OB.BF3C.CCl4D.PCl5