本试题 “下表中的数据是破坏1 mol物质中的化学键所消耗的能量(kJ):根据上述数据问题。(1)下列物质本身具有的能量最低的是 _____(填序号)A.H2 B.Cl2C.Br2 D.I...” 主要考查您对杂化轨道理论(中心原子杂化方式)
键能、键长、键角
化学键与化学反应中能量变化的关系
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 杂化轨道理论(中心原子杂化方式)
- 键能、键长、键角
- 化学键与化学反应中能量变化的关系
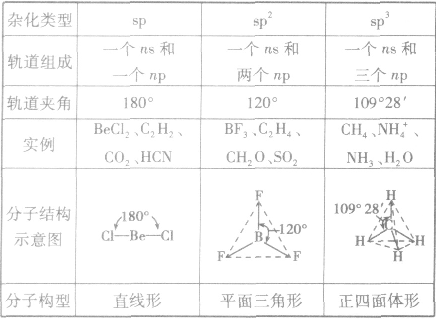
杂化轨道理论:
是鲍林为了解释分子的立体结构提出的。中心原子杂化轨道、孤电子对数及与之相连的原子数间的关系是:杂化轨道数=孤电子对数+与之相连的原子数。杂化前后轨道总数比变,杂化轨道用来形成σ键或容纳孤对电子,未杂化的轨道与杂化轨道所在平面垂直,可用来形成π键。
常见杂化方式:
(1)sp杂化:直线型 如:CO2、CS2
(2)sp2杂化:平面三角形(等性杂化为平面正三角形) 如:BCl3 C2H4
不等性杂化为V字型 如:H2O H2S OF2
(3)sp3杂化:空间四面体(等性杂化为正四面体) 如:CH4、CCl4
不等性杂化为三角锥 如:NH3 PCl3 H3O+
sp3d杂化:三角双锥
sp3d2杂化:八面体(等性杂化为正八面体)
是鲍林为了解释分子的立体结构提出的。中心原子杂化轨道、孤电子对数及与之相连的原子数间的关系是:杂化轨道数=孤电子对数+与之相连的原子数。杂化前后轨道总数比变,杂化轨道用来形成σ键或容纳孤对电子,未杂化的轨道与杂化轨道所在平面垂直,可用来形成π键。
常见杂化方式:
(1)sp杂化:直线型 如:CO2、CS2
(2)sp2杂化:平面三角形(等性杂化为平面正三角形) 如:BCl3 C2H4
不等性杂化为V字型 如:H2O H2S OF2
(3)sp3杂化:空间四面体(等性杂化为正四面体) 如:CH4、CCl4
不等性杂化为三角锥 如:NH3 PCl3 H3O+
sp3d杂化:三角双锥
sp3d2杂化:八面体(等性杂化为正八面体)
分子的构型与杂化类型的关系:
共价键的键参数:
(1)键能:指气态基态原子形成1mol化学键释放的最低能量。键能越大,化学键越稳定。
(2)键长:指成键原子的核间距。键长越短,共价键越稳定。
注意:我们通常通过比较两原子的共价半径来比较共价单键键长的大小,但共价键的键长并不等于两原子的共价半径之和。
(3)键角:在多原子分子内,两个共价键之间的夹角。
键角是描述分子立体结构的重要参数。多原子分子的键角是一定的,表明共价键具有方向性。

说明:键长、键能决定共价键的强弱和分子的稳定性。原子半径越小,键长越短,键能越大,分子越稳定。例如, 分子中:
分子中:
X原子半径: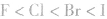
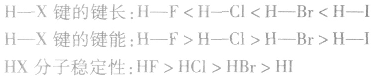
(1)键能:指气态基态原子形成1mol化学键释放的最低能量。键能越大,化学键越稳定。
(2)键长:指成键原子的核间距。键长越短,共价键越稳定。
注意:我们通常通过比较两原子的共价半径来比较共价单键键长的大小,但共价键的键长并不等于两原子的共价半径之和。
(3)键角:在多原子分子内,两个共价键之间的夹角。
键角是描述分子立体结构的重要参数。多原子分子的键角是一定的,表明共价键具有方向性。

说明:键长、键能决定共价键的强弱和分子的稳定性。原子半径越小,键长越短,键能越大,分子越稳定。例如,
 分子中:
分子中: X原子半径:
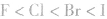
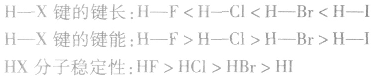
化学键与化学反应中能量变化的关系:
断开化学键要吸收能量,形成化学键要释放能量,通过化学键的键能可以计算断开化学键或形成化学键所需的能量。
反应热与键能的关系:
化学反应的热效应来源于化学反应过程中断裂旧化学键并形成新化学键时的能量变化。当破坏旧化学键所吸收的能量小于形成新化学键所释放的能量时,为放热反应;
当破坏旧化学键所吸收的能量大于形成新化学键所释放的能量时,为吸热反应。

若 反应为放热反应;若
反应为放热反应;若 或
或 ,反应为吸热反应。
,反应为吸热反应。
断开化学键要吸收能量,形成化学键要释放能量,通过化学键的键能可以计算断开化学键或形成化学键所需的能量。
反应热与键能的关系:
化学反应的热效应来源于化学反应过程中断裂旧化学键并形成新化学键时的能量变化。当破坏旧化学键所吸收的能量小于形成新化学键所释放的能量时,为放热反应;
当破坏旧化学键所吸收的能量大于形成新化学键所释放的能量时,为吸热反应。

若
 反应为放热反应;若
反应为放热反应;若 或
或 ,反应为吸热反应。
,反应为吸热反应。 发现相似题
与“下表中的数据是破坏1 mol物质中的化学键所消耗的能量(kJ):根...”考查相似的试题有:
- 砷化镓(GaAs)属于第三代半导体,用它制造的灯泡寿命是普通灯泡的100倍,而耗能只有其10%。推广砷化镓等发光二极管(LED)照明,...
- C和Si元素在化学中占有极其重要的地位。(1)写出Si的基态原子核外电子排布式______________。从电负性角度分析,C、Si和O元素...
- 氮元素可形成多种离子,如N3-、N3-、NH2-、NH4+、N2H5+、N2H62+等,其中N2H62+、N2H5+是由中性分子结合质子形成的,有类似于N...
- 关于含正离子N5+的化合物N5ASF6,下列叙述中错误的是 A.N5+共有34个核外电子B.N5+中氮原子间以离子键结合C.化合物N5ASF6中...
- 下列化合物中既有离子键又有极性共价键的是A.CaCl2B.H2SC.NaOHD.Na2O2
- 下列变化过程不需要破坏化学键的是A.碘的升华B.铝与强碱溶液反应C.食盐溶解于水D.氯气溶于水
- 判断下列有关化学基本概念的依据不正确的是( )A.溶液与胶体:能否产生丁达尔效应B.氧化还原反应:反应前后元素的化合价是...
- 下列物质中既有离子键又有共价键的是A.MgCl2B.SiO2C.H2O2D.Na2O2
- (17分)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成...
- 下列物质中,含离子键的是 A.H2B.KClC.NH3D.HCl