本试题 “在硫酸铜溶液中加入碘化钾溶液,有白色沉淀生成,溶液的颜色则由蓝色变为深黄色,经分析证明白色沉淀是碘化亚铜。表示这个氧化还原反应的离子方程式是[ ]A. C...” 主要考查您对离子方程式
铜盐(二价铜)
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 离子方程式
- 铜盐(二价铜)
用实际参加反应的离子符号表示离子反应的式子。
离子方程式书写规则:
①写:写出化学反应方程式
②拆:把易溶于水、易电离的物质写成离子形式,难容难电离的物质及气体等仍用化学式表示
③删:删去方程式两边不参加反应的离子
④查:检查离子方程式两边各元素的原子个数和电荷总数是否相等
离子方程式书写及正误的判断方法:
①判断反应是否在水溶液中进行
因为电解质在水溶液中可以电离为自由移动的离子,在这种条件下才能发生离子反应。
②判断反应能否发生。
如果反应不能发生,当然也就没有离子方程式可言。
③判断反应物、生成物是否正确。
④判断质量和电荷是否守恒。
离子方程式不仅要质量守恒,而且反应前后各离子所带电荷总数必须相等。
⑤判断氧化物、难溶物、气体、单质、难电离的弱酸、弱碱、水是否写成了分子形式,而易电离的物质是否写成离子形式。
⑥判断连接符号“=”和“
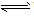 ”及状态符号“↑”和“↓”运用是否正确。
”及状态符号“↑”和“↓”运用是否正确。 强电解质的电离、不可逆反应、双水解反应用“=”;弱电解质电离、可逆反应、水解反应用“
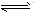 ”。复分解反应、水解反应生成的难溶物用“↓”,气体用“↑”;单水解反应生成的难溶物不用“↓”,气体不用“↑”。
”。复分解反应、水解反应生成的难溶物用“↓”,气体用“↑”;单水解反应生成的难溶物不用“↓”,气体不用“↑”。 ⑦判断微溶物的处理是否正确。
微溶物做反应物时,一般用离子形式,做生成物时一般用分子式。
⑧判断反应物的滴加顺序与方程式中生成物是否一致。
如:把碳酸钠溶液滴加到盐酸溶液中,和把盐酸滴加到碳酸钠溶液中反应产物是不同的。
⑨判断反应物的相对量与产物是否一致。
有些反应因反应物的量不同会生成不同的产物。如:CO2、SO2、H2S等气体与碱溶液反应时,若气体少量,则生成正盐;若气体过量,则生成酸式盐。
⑩判断电解质在写成离子形式时阴阳离子个数比是否合理。
如Ba(OH)2溶液和稀H2SO4反应的离子方程式往往错误写成:
 ,正确为:
,正确为: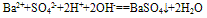
书写与量有关的离子方程式:
基本方法是:把物质的量少的物质的系数定为1,其他物质按最大量消耗。
1.因滴加顺序不同造成连续反应
- HCl与Na2CO3
向Na2CO3溶液中滴入盐酸溶液至过量,其离子反应分步写 (1)CO32-+H+==HCO3- (2)HCO3-+H+==CO2↑+H2O
若向盐酸溶液中滴入Na2CO3溶液至不再产生气体,其离子反应一步完成 CO32-+2H+==CO2↑+H2O
若向足量Na2CO3溶液中加入少量的盐酸溶液,其离子方程式为: CO32-+H+==HCO3-
- HCl与NaAlO2
向Na2CO3溶液中滴入盐酸溶液至过量,其离子反应分步写 (1)CO32-+H+==HCO3- (2)HCO3-+H+==CO2↑+H2O
若向盐酸溶液中滴入Na2CO3溶液至不再产生气体,其离子反应一步完成 CO32-+2H+==CO2↑+H2O
若向足量Na2CO3溶液中加入少量的盐酸溶液,其离子方程式为: CO32-+H+==HCO3-
- AlCl3与NaOH
向AlCl3溶液中滴入NaOH溶液至过量,其离子反应分步写 (1)Al3++3OH-==Al(OH)3↓ (2)Al(OH)3+OH-==AlO2-+2H2O
若向NaOH溶液中加入少量AlCl3溶液,其离子反应一步完成 Al3++4OH-==AlO2-+2H2O
若向足量Al2(SO4)3溶液中加入少量的NaOH溶液,其离子方程式为: Al3++3OH-==Al(OH)3↓
- AgNO3与NH3·H2O
向AgNO3溶液中滴入稀NH3·H2O至过量,其离子反应分步写(1) Ag++NH3·H2O==AgOH↓+NH4+ (2)AgOH+2NH3·H2O==Ag(NH3)2++OH-+2H2O
若向NH3·H2O溶液中加入少量AgNO3,其离子反应一步完成 Ag++3NH3·H2O==Ag(NH3)2++OH-+NH4++2H2O
若向足量AgNO3溶液中滴入少量NH3·H2O,其离子方程式为:Ag++NH3·H2O==AgOH↓+NH4+
- CO2与NaOH
向NaOH溶液中通人CO2气体至过量,其离子反应分步写 (1)2OH-+CO2==CO32-+H2O (2)CO32-+CO2+H2O==2HCO3-
若向足量NaOH溶液中通人少量CO2气体,其离子方程式为: 2OH-+CO2==CO32-+H2O
若向NaOH溶液中通人过量CO2气体,其离子反应一步完成 OH-+CO2==HCO3-
2.过量型:
向足量的Ca(HCO3)2溶液中逐渐滴入NaOH溶液 OH-+Ca2++HCO3-==H2O+CaCO3↓
向足量的NaOH溶液中逐渐滴入Ca(HCO3)2溶液 Ca2++2HCO3-+2OH-==2H2O+CaCO3↓+CO32-
Fe与HNO3 :铁过量时:Fe+4HNO3==Fe(NO3)3+NO↑+2H2O
铁不足时:3Fe+8HNO3==3Fe(NO3)2+2NO↑+4H2O
3.定量型:
因还原性I->Fe2+>Br-,所以在FeI2或者FeBr2中通入一定量的Cl2,发生不同的离子反应,依次为:
(1)2I-+Cl2==2Cl-+I2(2)2Fe2++Cl2==2Fe3++2Cl-(3)2Br-+Cl2==2Cl-+Br2
4.目标型
向明矾溶液逐滴滴加Ba(OH)2溶液至硫酸根离子刚好沉淀完全 Al3++SO42-+Ba2++4OH-==AlO2-+2BaSO4↓+2H2O
向明矾溶液逐滴滴加Ba(OH)2溶液至铝离子刚好沉淀完全 Al3+SO42-+Ba2++3OH-==Al(OH)3↓+2BaSO4↓
硫酸铜:
五水合硫酸铜(CuSO4·5H2O)为天蓝色晶体,水溶液呈弱酸性,俗名胆矾或蓝矾。硫酸铜是制备其他铜化合物的重要原料。同石灰乳混合可得波尔多液,用作杀菌剂。硫酸铜也是电解精炼铜时的电解液。
硫酸铜的物理性质和化学性质:
(1)物理性质:白色粉末状固体,不溶于乙醇和乙醚,易溶于水,水溶液呈蓝色,是强酸弱碱盐,水溶液呈弱酸性。将硫酸铜溶液浓缩结晶,可得五水硫酸铜蓝色晶体,俗称胆矾、铜矾或蓝矾。
(2)化学性质:
①二价铜与碱反应生成蓝色沉淀Cu(OH)2,Cu(OH)2溶于氨水形成深蓝色溶液[Cu(NH3)4]2+,此性质可以检验Cu2+。无水硫酸铜遇水变成蓝色(CuSO4·5H2O),可作为水的检验的依据。
②胆矾在常温常压下很稳定,不潮解,在干燥的空气中会逐渐风化(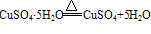 ),加热到45℃时失去2分子结晶水,110℃时失去4分子结晶水,150℃失去全部结晶水。将胆矾加热至650℃高温,可分解为黑色氧化铜、二氧化硫和氧气。
),加热到45℃时失去2分子结晶水,110℃时失去4分子结晶水,150℃失去全部结晶水。将胆矾加热至650℃高温,可分解为黑色氧化铜、二氧化硫和氧气。
(3)Cu2+的化学性质:能被活泼金属将其从盐溶液中置换出来:例:Cu2++Fe==Cu+Fe2+
硫酸铜的用途和制法:
(1)用途:硫酸铜较重要的铜盐之一,在电镀、印染、颜料、农药等方面有广泛的应用。无机农药波尔多液就是硫酸铜和消石灰的混合液,是一种良好的杀菌剂,可防止多种作物的病害。硫酸铜也常用来制备其他铜的化合物和电解精炼铜的电解液。
(2)制法:五水合硫酸铜可由铜或氧化铜与硫酸作用后,浓缩结晶而制得。在实验室中可用浓硫酸氧化金属铜来制取无水硫酸铜。
与“在硫酸铜溶液中加入碘化钾溶液,有白色沉淀生成,溶液的颜色...”考查相似的试题有:
- 下表列出了A~M 13种元素在周期表中的位置:1A 2 BCDE 3FGH IJK4
- 下列离子方程式中正确的是( )A.氯化铵稀溶液中滴加少量氢氧化钠稀溶液:NH4++OH-═NH3•H2OB.氯化铝溶液中加入过量的氨水:...
- 下列离子方程式中正确的是A.向NaHSO4溶液中逐滴加入Ba(OH)2溶液,至SO42-沉淀完全;2H++SO42-+Ba2++2OH-═BaSO4↓+2 H2OB...
- 下列反应的离子方程式正确的是A.用FeCl3溶液腐蚀印刷电路板:2Fe3++Cu===2Fe2++Cu2+B.氢氧化钡溶液跟硫酸反应:OH-+H+==...
- 下列离子方程式书写正确的是( )A.氢氧化铝溶于氢氧化钠溶液:Al(OH)3+3OH-=AlO2-+3H2OB.AlCl3溶液中加入足量的氨水:Al...
- 下列A~D四组反应中,其中I和Ⅱ可用同一个离子方程式表示的是[ ]ⅠⅡA.把金属铁放入稀硫酸中 把金属铁放入稀硝酸中B.向Ca(HCO3)2...
- 下列离子方程式表达正确的是A.将氯气溶于水制备次氯酸:Cl2+H2O=2H++Cl-+ClO-B.向Fe(OH)2中加入足量的稀HNO3:Fe(OH...
- 下列离子方程式中,不正确的是 ( )A.向FeBr2溶液中通入少量的Cl2:2Fe2++Cl2=2Fe3++2Cl-B.向NH4Al(SO4)2溶液中滴入Ba(OH)...
- 下列说法中用离子方程式表达正确的是 ( )A.用含氢氧化铝的药物治疗胃酸过多症:OH-+H+=H2OB.用亚硫酸钾溶液吸收硫酸工业...
- 下列离子方程式书写正确的是 ( )A.向氧化铁中加入氢碘酸:Fe2O3+6H++2I-=2Fe2++I2+3H2OB.Cu片插入FeCl3溶液中:C...