本试题 “某化学课外活动小组对当地农村甲、乙两化工厂排放的大量工业废水探讨综合治理的办法. 经多次勘测和实验分析初步断定两厂排放的废水 中含有K+、Cu2+、OH-、NO...” 主要考查您对水污染与防治
离子的检验
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 水污染与防治
- 离子的检验
水体污染的定义:
大量的污染物质排入水体,超过水体的自净能力使水质恶化,水体及其周围的生态平衡遭到破坏,对人类健康、生活和生产活动等造成损失和威胁的情况。
水体污染来源:
a.工业污染:座水、废渣、废气《工业“三反”》。
b.农业污染:化肥、农药的不合理使川。
c.生活污染:含磷洗涤剂的大量使用、生活污水的任意排放等。
防治措施:
a.工业上:通过应用新技术、新工艺减少污染物的产生,同时对污染的水体作处理使之符合排放标准。
b.农业上:提们使川农家肥,合理使用化肥和农药。
c.生活污水也应逐步实现欲中处理和排放。
水体的自净能力:
广义的水体自净是指在物理、化学和生物作用下.受污染的水体逐渐自然净化,水质复原的过程。,狭义的水体自净是指水体叶I微生物氧化分解有机污染物而使水体净化的过程。水体自净大致分为三类,即物理净化、化学净化和生物净化。它们同时发生,相互影响,共同作用。
(1)物理净化。物理净化是指污染物质由于稀释、扩散、混合和沉淀等过程而浓度降低。污水进入水体后,大颗粒的不溶性固体在水流较弱的地方逐渐沉入水底,形成污泥。悬浮体、胶体和可溶性污染物因混合、稀释,浓度逐渐降低。
(2)化学净化。化学净化是指污染物由于氧化还原、酸碱反应、分解、化合和吸附凝聚等化学或物理作用而浓度降低。流动的水体从水面上大气中溶人氧气,使污染物中铁、锰等重金属离子氧化,生成难溶性物质析出沉降。某些元素在一定酸性环境中,形成易溶性化合物,随水漂移而稀释;在中性或碱性条件下,某些元素形成难溶化合物而沉降。天然水中的胶体,吸附和凝聚水中悬浮物质微粒,随水流移动或逐渐沉降。
(3)生物净化,又称生物化学净化。是指生物活动尤其是微生物对有机物的氧化分解使污染物质的浓度降低。
城市污水及处理:
(1)城市污水城市污水包括生活污水、工业废水和径流污水等,由城市排水管网汇集并输送到污水处理厂进行处理。城市污水的污染,一般经历三个历史时期:病源污染期、总体污染期和新污染期。在病源污染期,城市污水主要是生活污水。由于污水中含有病菌和病毒,污水排入水体后往往会传染疾病。在总体污染期,随着工业的发展和人口的集中,城市污水量及所含的污染物种类不断增加。污水排入水体后,造成水体中悬浮物数量和生化需氧量越来越大,水体缺氧,水生生物灭绝。在新污染期,由于工业的高度发展,污水所含的污染物种类更加复杂。工业废水日益成为城市污水处理中的主要对象。
(2)城市污水处理城市污水处理分为三个级别.分别称为污水一级处理、污水二级处理、污水三级处理。一级处理应用物理处理方法,即用格栅、沉砂池、初沉池、活性污泥池、二次沉淀池等构筑物,去除污水中不溶解的污染物和寄生虫卵。二级处理应用生物处理方法,即主要通过微生物的代谢作用进行物质转化的过程,将污水巾各种复杂的有机物降解为简单的物质。生物处理对污水水质、水温、供氧量等都有一定的要求。三级处理是用生物化学(硝化一反硝化)法、碱化吹脱法或离子交换法除氮,用化学沉淀法除磷,用臭氧氧化法、活性炭法或超过滤法除去难降解有机物,用反渗透法除去盐类,用氯化法消毒等过程中的一种或几种组成的污水处理工艺。
大量的污染物质排入水体,超过水体的自净能力使水质恶化,水体及其周围的生态平衡遭到破坏,对人类健康、生活和生产活动等造成损失和威胁的情况。
水体污染来源:
a.工业污染:座水、废渣、废气《工业“三反”》。
b.农业污染:化肥、农药的不合理使川。
c.生活污染:含磷洗涤剂的大量使用、生活污水的任意排放等。
防治措施:
a.工业上:通过应用新技术、新工艺减少污染物的产生,同时对污染的水体作处理使之符合排放标准。
b.农业上:提们使川农家肥,合理使用化肥和农药。
c.生活污水也应逐步实现欲中处理和排放。
水体的自净能力:
广义的水体自净是指在物理、化学和生物作用下.受污染的水体逐渐自然净化,水质复原的过程。,狭义的水体自净是指水体叶I微生物氧化分解有机污染物而使水体净化的过程。水体自净大致分为三类,即物理净化、化学净化和生物净化。它们同时发生,相互影响,共同作用。
(1)物理净化。物理净化是指污染物质由于稀释、扩散、混合和沉淀等过程而浓度降低。污水进入水体后,大颗粒的不溶性固体在水流较弱的地方逐渐沉入水底,形成污泥。悬浮体、胶体和可溶性污染物因混合、稀释,浓度逐渐降低。
(2)化学净化。化学净化是指污染物由于氧化还原、酸碱反应、分解、化合和吸附凝聚等化学或物理作用而浓度降低。流动的水体从水面上大气中溶人氧气,使污染物中铁、锰等重金属离子氧化,生成难溶性物质析出沉降。某些元素在一定酸性环境中,形成易溶性化合物,随水漂移而稀释;在中性或碱性条件下,某些元素形成难溶化合物而沉降。天然水中的胶体,吸附和凝聚水中悬浮物质微粒,随水流移动或逐渐沉降。
(3)生物净化,又称生物化学净化。是指生物活动尤其是微生物对有机物的氧化分解使污染物质的浓度降低。
城市污水及处理:
(1)城市污水城市污水包括生活污水、工业废水和径流污水等,由城市排水管网汇集并输送到污水处理厂进行处理。城市污水的污染,一般经历三个历史时期:病源污染期、总体污染期和新污染期。在病源污染期,城市污水主要是生活污水。由于污水中含有病菌和病毒,污水排入水体后往往会传染疾病。在总体污染期,随着工业的发展和人口的集中,城市污水量及所含的污染物种类不断增加。污水排入水体后,造成水体中悬浮物数量和生化需氧量越来越大,水体缺氧,水生生物灭绝。在新污染期,由于工业的高度发展,污水所含的污染物种类更加复杂。工业废水日益成为城市污水处理中的主要对象。
(2)城市污水处理城市污水处理分为三个级别.分别称为污水一级处理、污水二级处理、污水三级处理。一级处理应用物理处理方法,即用格栅、沉砂池、初沉池、活性污泥池、二次沉淀池等构筑物,去除污水中不溶解的污染物和寄生虫卵。二级处理应用生物处理方法,即主要通过微生物的代谢作用进行物质转化的过程,将污水巾各种复杂的有机物降解为简单的物质。生物处理对污水水质、水温、供氧量等都有一定的要求。三级处理是用生物化学(硝化一反硝化)法、碱化吹脱法或离子交换法除氮,用化学沉淀法除磷,用臭氧氧化法、活性炭法或超过滤法除去难降解有机物,用反渗透法除去盐类,用氯化法消毒等过程中的一种或几种组成的污水处理工艺。
定义:
判断溶液中阴阳离子的存在情况。
几种常见离子的检验
常见酸、碱、盐的检验:
检验中的干扰和排除
在物质的检验过程中,由于待检物质中混有杂质、选用试剂不当或试剂不纯,包括仪器不清净、操作有误等.都会对检验造成干扰,应当予以排除。如鉴定CO32- 和SO42-共存时,我们不应该选用硝酸银试剂,而应选用硝酸钡或氯化钡试剂。再如,当CO32-和SO42-共存时,我们要检验出SO42-,则应先加盐酸酸化,排除CO32-离了的干扰后,再用氯化钡试剂进行检验。
检验结果的分析和判断
根据检验过程中所观察到的观象确定试样中存在哪些离子,必须把可能存在的离子全部考虑到,再根据每步检验的现象,肯定或否定某些离子的存在,逐步缩小范围,最终得出正确的结论。
判断溶液中阴阳离子的存在情况。
几种常见离子的检验
| 离子 | 所用试剂 | 方法 | 现象 | 化学方程式 |
| Cl- | AgNO3溶液和稀HNO3 | 将AgNO3溶液滴入待测液中,再加稀HNO3 | 生成白色沉淀.且不溶于稀HNO3 | AgNO3+NaCl==AgCl↓+NaNO3 |
| SO42- | BaCl2溶液和稀盐酸 | 将稀盐酸滴入待测液中,再加BaCl2溶液 | 滴加稀盐酸无现象,滴加 BaCl2溶液生成白色沉淀,且沉淀不溶于稀盐酸 | BaCl2+Na2SO4==BaSO4↓+ +2NaCl |
| CO32- | 盐酸(或HNO3) 和澄清石灰水 | 向待测液中加入盐酸(或HNO3).将产生的气体通入澄清石灰水中 | 产生无色无味的气体,此气体能使澄清的石灰水变浑浊 | Na2CO3+2HCl==2NaCl+H2O+ CO2↑ CO2+Ca(OH)2==CaCO3↓+H2O |
| OH- | 酚酞试液、紫色石蕊试液或红色石蕊试纸 | ①将酚酞试液滴入待测液中 ②将紫色石蕊试液滴入待测液中 ③将待测液滴在红色石蕊试纸上 |
①溶液变红 ②溶液变蓝 ③红色石蕊试纸变蓝 |
—— |
| H+ | 紫色石蕊试液或蓝色石蕊试纸 | ①将紫色石蕊试液滴入待测液中 ②将待测液滴在蓝色石蕊试纸上 |
①溶液变红 ②蓝色石蕊试纸变红 |
—— |
| NH4+ | 浓NaOH溶液 | 将浓NaOH溶液加入待测液中,加热,将湿润的红色石蕊试纸置于试管口(或用玻璃棒蘸浓盐酸置于试管口) | 放出有刺激性气味的气体,该气体能使湿润的红色石蕊试纸变蓝(或遇到浓盐酸产生大量白烟) | NH4Cl+NaOH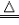 NaCl+H2O+NH3↑ NaCl+H2O+NH3↑ |
| Cu2+ | NaOH溶液 | 将NaOH溶液加入待测液中 | 生成蓝色沉淀 | CuSO4+2NaOH==Cu(OH)2↓ |
| Fe3+ | NaOH溶液 | 将NaOH溶液加入待测液中 | 生成蓝色沉淀 | FeCl3+3NaOH==Fe(OH)3↓+3NaCl |
常见酸、碱、盐的检验:
| 物质 | 检验方法 | 实验现象 | 典型化学式 |
| 硫酸及可溶性硫酸盐 | 取少量待检验溶液于试管中 (1)滴入紫色石蕊试液 (2)滴人稀盐酸和BaCl2溶液[或 Ba(NO3)2溶液] |
(1)溶液变红 (2)加入稀盐酸无明显现象,再加入BaCl2溶液有自色沉淀生成 |
H2SO4+BaCl2==BaSO4↓+2HCl Na2SO4+Ba(NO3)2==BaSO4↓+2NaNO3 |
| 盐酸及可溶性盐酸盐 | 取少量待检验溶液于试管中 (1)滴入紫色石蕊试液 (2)滴人AgNO3溶液和稀硝酸 |
(1)溶液变红 (2)有白色沉淀生成,且该沉淀不溶于稀硝酸 |
HCl+AgNO3=AgCl↓+HNO3 NaCl+AgNO3==AgCl↓+NaNO3 |
| 碳酸盐及碳酸氢盐 | 取少量待检验溶液于试管中 (1)加稀盐酸或稀硝酸 (2)将生成的气体通入澄清的石灰水中。 |
有气体生成,且该气体使澄清的石灰水变浑浊 | Na2CO3+2HCl=2NaCl+H2O+CO2↑ NaHCO3+HCl=NaCl+H2O+CO2↑ |
| 铵盐 | 将铵盐与碱混合共热 | 有刺激性气味气体生成 | NH4Cl+NaOH NaCl+NH3↑+H2O NaCl+NH3↑+H2O |
检验中的干扰和排除
在物质的检验过程中,由于待检物质中混有杂质、选用试剂不当或试剂不纯,包括仪器不清净、操作有误等.都会对检验造成干扰,应当予以排除。如鉴定CO32- 和SO42-共存时,我们不应该选用硝酸银试剂,而应选用硝酸钡或氯化钡试剂。再如,当CO32-和SO42-共存时,我们要检验出SO42-,则应先加盐酸酸化,排除CO32-离了的干扰后,再用氯化钡试剂进行检验。
检验结果的分析和判断
根据检验过程中所观察到的观象确定试样中存在哪些离子,必须把可能存在的离子全部考虑到,再根据每步检验的现象,肯定或否定某些离子的存在,逐步缩小范围,最终得出正确的结论。
发现相似题
与“某化学课外活动小组对当地农村甲、乙两化工厂排放的大量工业...”考查相似的试题有:
- 下列各种情况:①人的呼吸;②工业生产中废渣的随意堆放;③农业生产中大量施用农药、化肥;④生活污水的任意堆放;⑤用氢气作为燃...
- 水是宝贵的资源,我们应与水和谐相处,做到节水、惜水、护水.下列开发利用水资源的思路不正确的是( )A.合理用水,注意水...
- 人口的增加将导致水资源短缺,龙岩净水资源短缺告急 中水利用十分迫切,中水也是一种宝贵的水资源,对节省优质的水资源十分有...
- 我省某校化学兴趣小组的同学用洁净的塑料瓶从滏阳河中取回一定量的水样,然后进行如下研究分析: (1)将浑浊的河水样品倒入...
- 下列对环境和资源的认识,正确的是( )A.我国矿物种类齐全、矿物储量丰富,故可以无限开采B.我市的水资源十分丰富,因此无...
- 某学校附近的一化工厂排放的废水中含有大量的AgNO3、Fe(NO3)3和Ba(NO3)2,这种废水的直接排放既造成水资源的污染,又造成...
- 今年3月22日是第十九届“世界水日”,其主题是“城市用水:应对都市化挑战”。下图是某小组同学设计的实验室中净化黄泥水的流程图...
- (1)水是生命之源,对它的保护和合理利用已受到人们的普遍关注,请你说出“保护水资源,刻不容缓”的两点理由:①_______________...
- 下列说法错误的是( )A.硫酸铵化肥加入熟石灰研磨能嗅到刺激性氨味B.含Cl-的盐溶液能与AgNO3溶液反应,产生白色沉淀C.含S...
- 下列说法中不正确的是[ ]A.用铅笔芯的粉末可使锁的开启变得灵活B.在煤炉上放一盆水可以防止煤气中毒C.用盐酸和澄清的石灰...