本试题 “下列说法都正确的是[ ]①江河入海口三角洲的形成通常与胶体的性质有关②四川灾区重建使用了大量钢材,钢材是合金③“钡餐”中使用的硫酸钡是弱电解质④太阳能电池板...” 主要考查您对胶体
元素周期表
极性键、非极性键
强电解质、弱电解质
合金
塑料、纤维、橡胶
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 胶体
- 元素周期表
- 极性键、非极性键
- 强电解质、弱电解质
- 合金
- 塑料、纤维、橡胶
胶体:分散质粒子直径在10-9m~10-7m之间的分散系胶粒直径的大小是胶体的本质特征
胶体可分为固溶胶、液溶胶、气溶胶
①常见的液溶胶:Fe(OH)3、AgI、牛奶、豆浆、粥等
②常见的气溶胶:雾、云、烟等;
③常见的固溶胶:有色玻璃、烟水晶等胶体的性质:
丁达尔效应:
①当光束通过氢氧化铁胶体时,可以看到一条光亮的通路,这条光亮的通路是由于胶体粒子对光线散射(光波偏离原来方向而分散传播)形成的,即为丁达尔效应。
②布朗运动:粒子在不停地、无秩序的运动
③电泳:胶体粒子带有电荷,在电场的作用下,胶体粒子在分散剂里定向移动。一般来讲:金属氢氧化物,金属氧化物的胶粒吸附阳离子,胶体微粒带正电荷;非金属氧化物,金属硫化物的胶体胶粒吸附阴离子,胶体微粒带负电荷。
④胶体聚沉:向胶体中加入少量电解质溶液时,由于加入的阳离子(或阴离子)中和了胶体粒子所带的电荷,使胶体粒子聚集成为较大的颗粒,从而形成沉淀从分散剂里析出。该过程不可逆。
胶体的特性:
(1)丁达尔效应当一束光通过胶体时,胶体内会出现一条光亮的通路,这是由胶体粒子对光线散射而形成的,利用丁达尔效应可区分胶体和浊液。
(2)介稳性:胶体的稳定性介于溶液和浊液之间,在一定条件下能稳定存在,但改变条件就有可能发生聚沉。
(3)聚沉:给胶体加热、加入电解质或加入带相反电荷的胶体颗粒等均能使胶体粒子聚集成较大颗粒,从而形成沉淀从分散剂里析出。聚沉常用来解释生活常识,如长江三角洲的形成、明矾净水等。
(4)电泳现象:在电场作用下,胶体粒子在分散剂中作定向移动。电泳现象说明胶体粒子带电。电泳常用来分离提纯胶体,如工业上静电除尘。
分散系比较:
| 分散系 | 溶液 | 胶体 | 悬浊液 | 乳浊液 |
| 分散质粒子大小 | <1nm | 1~100nm | >100nm | >100nm |
| 分散质粒子结构 | 分子、离子 | 少量分子的结合体或大分子 | 大量分子聚集成的固体小颗粒 | 大量分子聚集成的液体小液滴 |
| 特点 | 均一、透明、稳定 | 多数均一、透明、较稳定 | 不均一、不透明、久置沉淀 | 不均一、不透明、久置分层 |
| 能否透过滤纸 | 能 | 能 | 不能 | —— |
| 实例 | 食盐水、蔗糖溶液 | Fe(OH)3(胶体)、淀粉胶体 | 泥水、石灰乳 | 牛奶、油漆 |
胶体发生聚沉的条件:
因胶粒带电,故在一定条件下可以发生聚沉:
- 向胶体中滴加电解质
- 向胶体中加入带相反电荷胶粒的胶体
- 加热
常见的胶体的带电情况:
- 胶粒带正电荷的胶体有:金属氧化物、金属氢氧化物。例如Fe(OH)3、Al(OH)3等。
- 胶粒带负电荷的胶体有:非金属氧化物、金属硫化物、硅酸胶体、土壤胶体。
- 胶粒不带电的胶体有:淀粉胶体。
- 特殊的,AgI胶粒随着AgNO3和KI相对量不同,而带正电或负电。若KI过量,则AgI胶粒吸附较多I-而带负电;若AgNO3过量,则因吸附较多Ag+而带正电。
注意:胶体不带电,而胶粒可以带电。
Fe(OH)3胶体的制备:
操作步骤:将烧杯中的蒸馏水加热至沸腾,向沸水中滴加5~6滴饱和FeCl3溶液,继续煮沸至呈红褐色为止。
离子方程式:Fe3++3H2O=(加热)=Fe(OH)3(胶体)+3H+
点拨:(1)淀粉溶液、蛋白质溶液虽叫做溶液,但属于胶体。
(2)胶体可以是液体,也可以是固体、气体,如烟、云、雾、有色玻璃等。
元素周期表编排原则:
(1)把电子层数相同的各种元素按原子序数递增的顺序从左至右排成横行。
(2)把最外层电子数相同的元素按电子层数递增的顺序由上到下排列成纵行。
注意:①元素周期表是元素周期律的具体表现形式,它反映了元素之间相互联系的规律。
②历史上第一个元素周期表是1869年俄国化学家门捷列夫在前人探索的基础上排成的,他将元素按相对原子质量由小到大依次排列,并将化学性质相似的元素放在一个纵行。
元素周期表的结构:
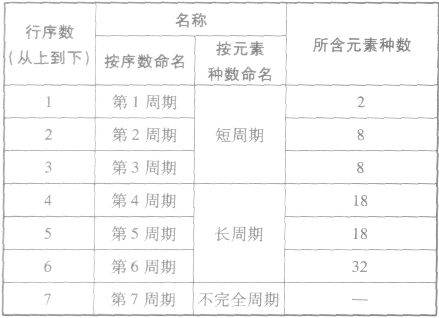
(1)周期
①周期的含义在元素周期表中,把电子层数相同的元素,按原子序数递增的顺序从左到右排成横行,这样每个横行为一个周期。现在使用的元素周期表有7个横行,即7 个周期。
②周期的划分
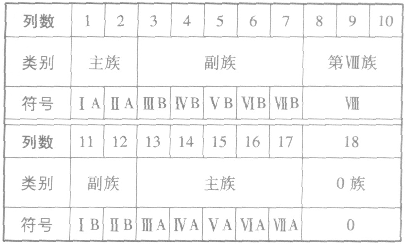
(2)族
①族的含义在周期表中,把不同横行(即周期)中最外层电子数相同的元素,按电子层数递增的顺序由上到下排成纵行,除第8、9、10三个纵行叫做第Ⅷ族外,其余15个纵行,每个纵行为一族。现在使用的元素周期表有18 个纵行,它们被划分为16个族。
②族的划分
(3)元素周期表中主族元素金属性和非金属性的递变
(1)非极性键:同种元素的原子间形成的共价键(共用电子对不偏移,成键原子双方不显电性)。
如:在非金属单质(H2 Cl2 O2)、共价化合物(H2O2 多碳化合物)、离子化合物(Na2O2 CaC2)中存在。
(2)极性键:不同元素的原子间形成的共价键(共用电子对偏向吸引电子能了强的一方,该元素显负价,偏离吸引电子能力弱的一方,该元素显正价)。如:在共价化合物(HCl H2O CO2 NH3)、某些离子化合物(NaOH Na2SO4 NH4Cl)中存在。
分子空间构型、键的极性与分子的极性:

化学键与物质类别:
1.只含有极性共价键的物质:一般是不同非金属元素构成的共价化合物。例如: 等。
等。
2.只含非极性共价键的物质:同种非金属元素构成的单质。例如: 、金刚石等。
、金刚石等。
3.既有极性键又有非极性键的物质。例如: 等。
等。
4.只含有离子键的物质:活泼非金属元素与活泼金属元素形成的化合物。例如: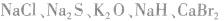 等。
等。
5.既有离子键又有非极性键的物质。例如: 等。
等。
6.既有离子键又有极性键的物质。例如: 等。
等。
7.由离子键、共价键、配位键构成的物质。例如: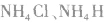 等。
等。
8.只含有共价键而无范德华力的物质。例如:金刚石、晶体硅、 等原子晶体。
等原子晶体。
9.由强极性键构成但又不是强电解质的物质。例如:HF。
10.没有化学键的物质。例如:稀有气体(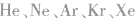 等)。
等)。
在水溶液里或熔融状态下,能全部电离的化合物。包括:强酸、强碱、大多数盐、活泼金属氧化物等;完全电离、不可逆、不存在电离平衡;电离方程式用“=”表示。
弱电解质:
在水溶液里或熔融状态下,不能全部电离的化合物。包括:弱酸、弱碱、少数盐等;部分电离、可逆、存在电离平衡,电离方程式用“
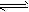 ”表示。
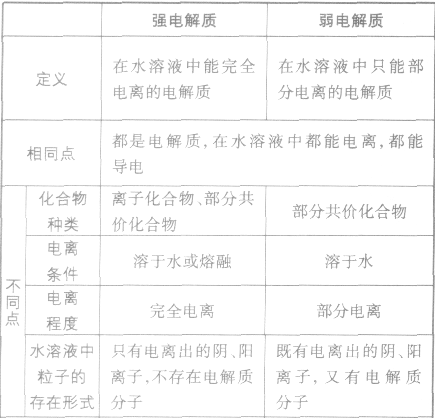
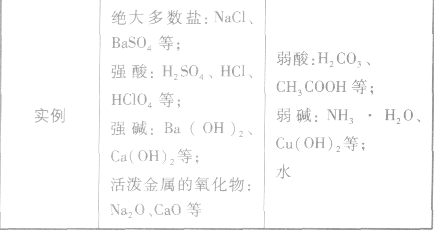
”表示。 强电解质和弱电解质的比较:
强弱电解质的判断依据:
1.在相同浓度、相同温度下,与强电解质做导电性对比实验.
2.浓度与pH的关系。如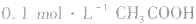 溶液的pH>1,则证明
溶液的pH>1,则证明 是弱电解质。
是弱电解质。
3.测定对应盐溶液的酸碱性。如 溶液呈碱性,则证明醋酸是弱电解质。
溶液呈碱性,则证明醋酸是弱电解质。
4.稀释前后的pH变化与稀释倍数的关系。例如,将pH=2的酸溶液稀释1000倍,若pH<5,则证明该酸为弱电解质;若pH=5,则证明该酸为强电解质。
5.采用实验证明电离平衡。如向醋酸溶液中滴人石蕊试液,溶液变红,再加入醋酸钠晶体,颜色变浅。
合金的概念:
由两种或两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质。
合金的特性:
合金与各成分金属相比,具有许多优良的物理、化学和机械性能。
(1)合金的硬度一般比它的成分金属的大。
(2)合金的熔点一般比它的成分金属的低。
钢:
(1)钢和生铁同属于铁的合金。将铁矿石冶炼成生铁,生铁进一步冶炼可成为钢。
(2)钢是用量最大、用途最广的合金,按其化学成分可分为两大类:碳素钢和合金钢。
(3)碳素钢俗称普通钢。根据含碳量的多少,碳素钢又可以分为三类,见下表:
| 合金名称 | 含碳 | 主要性质 |
| 低碳钢 | <0.3% | 韧性、焊接性好,但强度低 |
| 中碳钢 | 0.3%~0.6% | 强度高,韧性及加工性好 |
| 高碳钢 | >0.6% | 硬而脆,热处理后弹性好 |
| 名称 | 其他主要合金元素 | 主要特性 | 主要用途 |
| 锰钢 | 锰 | 韧性好,硬度大 | 钢轨、轴承、钢磨、挖掘机铲斗、坦克装甲 |
| 不锈钢 | 铬、镍 | 抗腐蚀性好 | 医疗器械、容器、炊具等 |
| 硅钢 | 硅 | 导磁性好 | 变压器、发电机和电动机的铁芯 |
| 钨钢 | 钨 | 耐高温,硬度大 | 刀具 |
其他几种常见合金的主要成分,性能和用途:
| 合金 | 主要成分 | 主要性能 | 主要用途 |
| 球墨铸铁 | 铁,碳,硅,锰 | 机械强度好 | 在某些场合可代替钢 |
| 黄铜 | 铜,锌 | 强度高、可塑性 好、易加工、耐腐蚀 |
机器零件、仪表、日用品 |
| 青铜 | 铜,锡 | 强度高、可塑性好、 耐磨、耐腐蚀 |
机器零件如轴承、齿轮等 |
| 白铜 | 镍,铜 | 光泽好、耐磨、 耐腐蚀、易加工 |
钱币、代替银做饰品 |
| 焊锡 | 锡,铅 | 熔点低 | 焊接金属 |
| 硬铝 | 铝,铜,锰,镁,硅 | 强度和硬度好 | 火箭、飞机、轮船等制造业 |
| 钛合金 | 钛,铝,钒 | 耐高温、耐腐蚀、高强度 | 用于宇航、飞机、造船,化学工业 |
| 金合金 | 金,银,铜,稀土元素 | 有光泽、易加工、耐磨、耐腐蚀、易导电 | 金饰品、电子元件、钱币、笔尖 |
| Ti-Fe合金 | Ti,Fe | 室温下吸收H2快,且吸收H2量大,稍稍加热放H2速率快 | 储氢合金 |
合金的分类:
(1)铝合金:常见的有镁铝合金、硬铝等。硬铝密度小,强度高,具有较强的抗腐蚀能力,是制造飞机和字宙飞船的理想材料。
(2)铜合金
(3)
(4)新型合金:钛合金、耐热合金和形状记忆合金等。
几种有色金属材料的比较及新型金属材料:
1.金,银,铜的重要物理性质,性能及应用比较
| 金 | 银 | 铜 | ||
| 物理性质 | 颜色 | 黄色 | 银白色 | 紫红色 |
| 硬度 | Au<Ag<Cu | |||
| 延展性 | Au>Ag>Cu | |||
| 导电性 | Ag>Cu>Au | |||
| 导热性 | Ag>Cu>Au | |||
| 性能 | 极高的抗腐蚀性 | 催化,抗腐蚀性 | 在潮湿空气中易锈蚀 | |
| 应用 | 电子工业,航空,航天工业 | 有机合成,能源开发,医用材料制造 | 电气和电子工业,建筑材料 | |
2.新型金属材料
(1)铀(U)用作核电站反应堆的核燃抖
(2)镅(Am)在烟雾探测器中用作烟雾监测材料
(3)钛(Ti)被誉为“21世纪的金属”,是一种“亲生物金属”
金属资源的合理开发和利用:
1.合理开采矿物地球上的金属矿产资源是有限的,而且是不可再生的。随着人类不断地开发利用,矿产资源日渐减少,节约并合理地开采矿产资源是合理利用金属资源最直接,最基本水的措施
2.防止金属腐蚀金属制品在使用过程中会因腐蚀而损坏,每年因腐蚀造成的钢铁资源损失占当年总产量的10%以上,因此防腐是避免金属资源损失、浪费的重要手段
3.回收和利用废旧金属回收的废旧金属制品,大部分可以重新制成金属或它们的化合物,再进行使用。例如废旧钢铁可以用于炼钢;废铁屑可用于制铁盐
4.寻找金属替代品随着金属资源的目益减少,利用可再生资源开发、研制出新型材料代替金属材料的应用,是当今社会的一项重要科研课题,例如已经研制出并已实际运用的高硬度、耐高温材料;新型的替代钢铁的无机非金属材料料;有机化工合成的各种强度的橡胶、塑料,复合材料等
合成材料:
又称人造材料,是人为地把不同物质经化学方法或聚合作用加工而成的材料,其特质与原料不同,如塑料、玻璃、钢铁等。三大合成材料:塑料、合成纤维、合成橡胶
塑料:
主要成分合成树脂(高聚物),还含有增塑剂和防老化剂等添加剂,一定属人工合成的。
热塑性塑料:线形结构受热会熔化、冷却会硬化,多次使用,如聚乙烯塑料,聚丙烯塑料等
热固性塑料:受热会交联成立体网状结构,一次使用酚醛树脂,脲醛树脂等
纤维:
天然纤维:属纤维素,棉花、麻等属蛋白质:羊毛和蚕丝等
人造纤维:用木材等为原料加工成的人造棉、人造丝、玻璃纸等仍属纤维素
合成纤维(六大纶) 用石油、天然气、煤核农副产品等为原料人工合成的高分子材料 锦纶(尼龙)、涤纶(的确良)、腈纶(人造羊毛)、维纶、氯纶、丙纶
橡胶:
(1)天然橡胶:聚异戊二烯
(2)合成橡胶:
通用橡胶:丁苯橡胶、氯丁橡胶、顺丁橡胶
特种橡胶:耐热耐酸碱的氟橡胶、耐高温耐严寒的硅橡胶
一般橡胶:线型结构,可塑性好,但强度和韧性差
硫化橡胶:加硫后通过硫桥交联成立体型的网状结构,强度和韧性高、弹性好、化学稳定
与“下列说法都正确的是[ ]①江河入海口三角洲的形成通常与胶体的...”考查相似的试题有:
- 下列现象或操作与物质的化学性质有关的是[ ]A. 焰色反应B. 石油的分馏C. 电解质溶液导电D. 丁达尔效应
- 判断下列有关化学基本概念的依据不正确的是( )A.溶液与胶体:能否产生丁达尔效应B.氧化还原反应:反应前后元素的化合价是...
- 现有25℃的硫酸铜饱和溶液300克,加热蒸发掉80克水后,再冷却到原来的温度,求析出CuSO4·5H2O多少克(已知25℃时,CuSO4的溶解...
- A、B、C三种短周期元素在元素周期表中的相对位置如图所示,已知A、C可分别与B形成化合物X和Y,A与B的质子数之和为C的质子数,...
- 某元素4p能级上有3个电子,该元素位于第_____周期_____族,其M能层上有_____个电子,4p能级上有_________ 个未成对电子;原子...
- 下列是元素周期表的前三周期中的部分元素:族周期ⅠAⅡAⅢAⅣAⅤAⅥAⅦA0一①②二③④⑤⑥⑦三⑧⑨⑩(11)(1)这些元素中,最活泼的非金属元...
- 下列反应属于离子反应的是( )A.H2和O2反应生成H2OB.Zn片投入到稀H2SO4中C.KMnO4加热分解制取O2D.NH3遇HCl气体生成白烟...
- 金属具有良好的导电、导热及延展性等,因此广泛应用于制造各种材料.请回答下列问题:(1)家庭中“钢精锅”是由铝合金做成的,...
- “鸟巢”被评为2008年世界最具影响力的十大建筑之一.合金钢Q460是支撑“鸟巢”的铁骨钢盘,除含有铁元素外,还含有Mn(锰)、Ti...
- 废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧黄铜(Cu、Zn合金,含少量杂质Fe)制备胆矾晶体(CuSO4·5H...