本试题 “金属钙线是炼制优质钢材的脱氧脱磷剂,某钙线的主要成分为金属M和Ca,并含有3.5%(质量分数)CaO(1)Ca元素在周期表中位置是______,其原子结构示意图______...” 主要考查您对氧化还原反应的配平
物质性质的研究
电子式的书写
离子的检验
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 氧化还原反应的配平
- 物质性质的研究
- 电子式的书写
- 离子的检验
配平简介:
化学反应方程式严格遵守质量守恒定律,书写化学反应方程式写出反应物和生成物后,往往左右两边各原子数目不相等,不满足质量守恒定律,这就需要通过配平来解决。
配平原则:
(1)电子守恒原则:反应中还原剂失去电子的总数与氧化剂得到电子的总数相等
(2)电荷守恒原则:若为离子反应,反应前后离子所带正负电荷总数相等
(3)质量守恒原则:反应前后各元素的原子个数相等
配平步骤:
(1)一标:标明反应前后化合价有变化的元素的化合价
(2)二等:通过求最小公倍数使化合价升降总值相等
(3)三定:确定氧化剂与还原剂的化学计量数
氧化剂(还原剂)化学计量数=降(升)价的最小公倍数÷1mol氧化剂(还原剂)降(升)价总数
(4)四平:用观察法配平其他物质的化学计量数
(5)五查:检查质量与电荷、电子是否分别守恒
配平技巧:
(1)逆向配平法:部分氧化还原反应、自身氧化还原反应等可用逆向配平法,即选择氧化产物、还原产物为基准物来配平(一般从反应物很难配平时,可选用逆向配平法)
例:
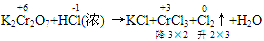
通过表明氧化产物、还原产物化合价的升降,确定CrCl3、Cl2的计量数为2和3,然后再用观察法配平。
(2)设“1”配平法:设某一反应物或生成物(一般选用组成元素较多的物质作基准物)的化学计量数为1,其余各物质的化学计量数可根据原子守恒原理列方程求得。
例:P4O+Cl2→POCl3+P2Cl6
可令P4O前的系数为1,Cl2的系数为x,则
1P4O+xCl2→POCl3+3/2P2Cl6 ,再由Cl原子守恒得2x=3+3/2×6 得x=6 即可配平
(3)零价配平法:先令无法用常规方法确定化合价的物质中各元素均为零价,然后计算出各元素化合价的升降值,并使元素化合价升降总数相等,最后用观察法配平其他物质的化学计量数。
例:Fe3C+HNO3=Fe(NO3)3+CO2↑+NO2↑+H2O
复杂化合物Fe3C按照常规方法分析,无法确定其Fe和C的具体化合价,此时可令组成物质的各元素化合价为零价,根据化合价升降法配平。
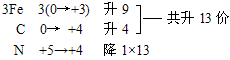
再用观察法确定物质的化学计量数。
(4)整体标价法:当某元素的原子在某化合物中有数个时,可将它作为一个整体对待,根据化合物中元素化合价代数和为零原则予以整体标价。
例:S+Ca(OH)2→CaSx+Ca2S2O3+H2O
生成物CaSx、Ca2S2O3中的Sx、S2作为一个整体标价为-2、+4价,则化合价升降关系为:
Sx 0→-2 降2×2
S2 0→+4 升4×1
即可配平。
(5)缺项配平法:一般先确定氧化剂、还原剂、氧化产物、还原产物的化学计量系数,再通过比较反应物与生成物,确定缺项(一般为H2O、H+或OH-),最后观察配平。
(6)有机氧化还原反应的配平:有机物中元素的化合价一般来讲,氢元素显+1价,氧元素显-2价,然后再根据化合价的代数和为零求酸碳元素的平均化合价。
氧化还原反应方程式配平的一般方法与步骤:
- 一般方法:从左向右配。
- 步骤:标变价,找变化,求总数,配系数。
- 标出元素化合价变化的始态和终态
- 求升价元素或降价元素化合价的变化数
- 求化合价变化数的最小公倍数,分别作为氧化剂或还原剂的系数
- 配平变价元素
- 用观察法配平其他元素
- 检查配平后的方程式是否符合质量守恒定律(离子方程式还要看电荷是否守恒)
如: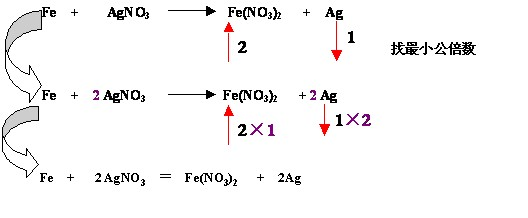
特殊技巧:
配平时若同一物质内既有元素的化合价上升又有元素的化合价下降,若从左向右配平较困难,可以采用从右向左配平,成为逆向配平法。
研究对象:
物质的物理性质、化学性质物质性质。
研究方法:
观察与问题、假设与预测、实验与事实、解释与结论、表达与交流、扩展与迁移。
定义:
在化学反应中,一般是原子的最外层电子数目发生变化。为了简便起见,化学中常在元素符号周围用小黑点“· ”或小叉“×”来表示元素原子的最外层电子,相应的式子叫做电子式。
(1)原子的电子式:H· 、Na· 、
(2)阳离子的电子式:不画出离子最外层电子数,元素右上角标出“n+”电荷字样:Na+、Al3+、Mg2+
(3)阴离子的电子式:要画出最外层电子数,用 “[ ]”括起来,右上角标出“n-”: 、
、 、
、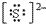
(4)离子化合物的电子式:由阴、阳离子的电子式组成,相同离子不能合并: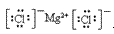 、
、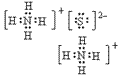
(5)共价化合物的电子式:画出离子最外层电子数: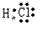 、
、
(6)用电子式表示物质形成的过程:
氯化氢的形成过程: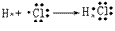
氯化镁的形成过程: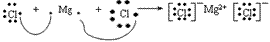
结构式:
共价键中的每一对共用电子用一根短线表示,未成键电子不写出,物质的电子式就变成了结构式。
例如: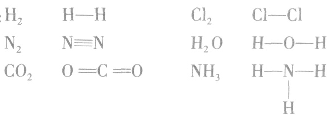
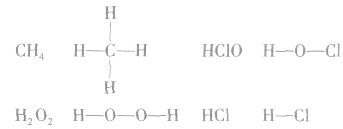
书写电子式的常见错误:
1.漏写未参与成键的电子,如: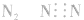
2.化合物类型不清,漏写或多写“[]”及错写电荷数,如: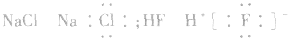
3.书写不规范,错写共用电子对如:N2的电子式为: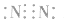 ,不能写成:
,不能写成: ,更不能写成:
,更不能写成: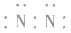 或
或 。
。
4.不考虑原子间的结合顺序如:HClO的电子式为 ,而非
,而非 。因氧原子需形成2对共用电子才能达到稳定结构,而H、 Cl各需形成1对共用电子就能达到稳定结构。
。因氧原子需形成2对共用电子才能达到稳定结构,而H、 Cl各需形成1对共用电子就能达到稳定结构。
5.不考虑原子最外层有几个电子均写成8电子结构如: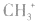 的电子式为
的电子式为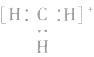 ,而非
,而非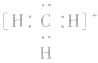 , 因
, 因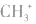 中碳原子最外层应有6个电子(包括共用电子),而非8个电子。
中碳原子最外层应有6个电子(包括共用电子),而非8个电子。
6.不清楚A如型离子化合物中两个B是分开写还是写一块如: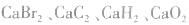 中
中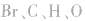 均为-l 价,Br-、H-已达到稳定结构,应分开写;C原子得一个电子,最外层有5个电子,需形成三对共用电子才能达到稳定结构,不能分开写;氧原子得一个电子,最外层有7个电子,需形成一对共用电子才能达到稳定结构,也不能分开写。它们的电子式分别为:
均为-l 价,Br-、H-已达到稳定结构,应分开写;C原子得一个电子,最外层有5个电子,需形成三对共用电子才能达到稳定结构,不能分开写;氧原子得一个电子,最外层有7个电子,需形成一对共用电子才能达到稳定结构,也不能分开写。它们的电子式分别为: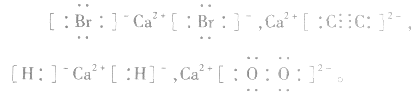
(1)焰色反应:Na+:黄色;K+:紫色(透过蓝色钴玻璃观察);Ca2+:砖红色;
(2)H+:H+酸性。遇紫色石蕊试液变红,遇湿润蓝色石蕊试纸变红;
(3)NH4+:在试液中加强碱(NaOH)加热,产生使湿润红色石蕊试纸变蓝的气体;NH4++OH-
 NH3↑+H2O;NH3+H2O
NH3↑+H2O;NH3+H2O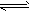 NH3?H2O
NH3?H2O NH4++OH-
NH4++OH- (4)Fe3+:①通KSCN或NH4SCN溶液呈血红色:Fe3++SCN-==[Fe(SCN)]2+;②通NaOH溶液红褐色沉淀:Fe3++3OH-==
Fe(OH)3↓
(5)Fe2+:①遇NaOH溶液生成白色沉淀在空气中迅速转化成灰绿色最后变成红褐色沉淀:Fe3++2OH-=Fe(OH)2↓;
4Fe(OH)2+O2+2H2O==4Fe(OH)3;
②试液中加KSCN少量无明显变化再加氯水出现血红色: 2Fe2++Cl2==2Fe3++2Cl-;Fe3++SCN-==[Fe(SCN)]2+
(6)Mg2+:遇NaOH溶液有白色沉淀生成,NaOH过量沉淀不溶解:Mg2++2OH-==Mg(OH)2↓,但该沉淀能溶于NH4Cl溶液;
(7)Al3+:遇NaOH溶液(适量)有白色沉淀生成,NaOH溶液过量沉淀溶解:Al3++3OH-==Al(OH)3↓;Al(OH)3+OH-==
AlO2-+2H2O
(8)Cu2+:遇NaOH溶液有蓝色沉淀生成,加强热变黑色沉淀:Cu2++2OH-==Cu(OH)2↓;Cu(OH)2
 CuO+H2O
CuO+H2O (9)Ba2+:遇稀H2SO4或硫酸盐溶液有白色沉淀生成,加稀HNO3沉淀不溶解:Ba2++SO42-==BaSO4↓
(10)Ag+: ①加NaOH溶液生成白色沉淀,此沉淀迅速转变为棕色沉淀溶于氨水Ag++OH-==AgOH↓;2AgOH==Ag2O+H2O;AgOH+2NH3?H2O==[Ag(NO3)2]OH+2H2O
②加稀HCl或可溶性氧化物溶液再加稀HNO3生成白色沉淀:Ag++Cl-==AgCl↓
(11)OH-:OH-碱性:①遇紫色石蕊试液变蓝;②遇酚酞试液变红;③遇湿润红色石蕊试纸变蓝;
(12)Cl-:遇AgNO3溶液有白色沉淀生成,加稀HNO3沉淀不溶解:Ag++Cl-=AgCl↓
(13)Br-:加AgNO3溶液有浅黄色沉淀生成,加稀HNO3沉淀不溶解:Ag++Br-=AgBr↓
(14)I-: ①加AgNO3溶液有黄色沉淀生成,加稀HNO3沉淀不溶解:Ag++I-=AgI↓;②加少量新制氯水后再加淀粉溶液显蓝色:2I-+Cl2=I2+2Cl-;I2遇淀粉变蓝
(15)S2-:①加强酸(非强氧化性)生成无色臭鸡蛋气味气体:S2-+2H+=H2S↑;②遇Pb(NO3)2或(CH3COO)2Pb试液生成黑色沉淀,遇CuSO4试液产生黑色沉淀:Pb2++S2-=PbS↓;Cu2++S2-=CuS↓
(16)SO42-:加可溶性钡盐[BaCl2或Ba(NO3)2]溶液有白色沉淀生成后再加稀HCl或稀HNO3沉淀不溶解:Ba2++SO42-=BaSO4↓
(17)SO32-:加强酸(H2SO4或HCl)把产生气体通入品红溶液中,品红溶液褪色:SO32-+2H+=H2O+SO2↑ SO2使品红溶液褪色
(18)CO32-:加稀HCl产生气体通入澄清石灰水,石灰水变浑浊:CO32-+2H+=H2O+CO2↑;CO2+Ca(OH)2=CaCO3↓+H2O
(19)HCO3-:取含HCO3-盐溶液煮沸,放出无色无味、使澄清石灰水变浑浊的气体;或向HCO3-溶液里加入稀MgSO4溶液,无现象,加热煮沸有白色沉淀MgCO3生成,同时放出CO2气体。
(20)NO3-:浓缩试液加稀硫酸和铜片加热有红棕色气体产生,溶液变成蓝色:
Cu+4H++2NO3-=Cu2++2NO2↑+2H2O
(21)PO43-:加AgNO3溶液产生黄色沉淀,再加稀HNO3沉淀溶解:3Ag++PO43-=Ag3PO4↓;Ag3PO4溶于稀HNO3酸。
与“金属钙线是炼制优质钢材的脱氧脱磷剂,某钙线的主要成分为金...”考查相似的试题有:
- 已知氧化性Fe3+>I2。向Fe I2溶液中通入一定量的Cl2,发生反应的离子方程式为:a Fe2++b I-+c Cl2→d Fe3++ e I2+ f Cl-。下...
- 物质在水溶液中有不同的行为。按要求回答下列问题:(1)Na2SO3溶液显碱性,其原因是______________________________(用离子...
- (7分)金属及其化合物在生产、生活中有广泛应用。(1)从结构角度分析Fe3+较Fe2+稳定的原因。(2)三氯化铁常温下为固体,...
- A、B、C、D四种短周期元素,原子序数依次增大,A、C同主族,C、D同周期,B原子最外层电子数是最内层电子数的3倍.A、B可形成A...
- 根据所学知识,回答以下问题:(1)Ni(CO)4是无色液体,沸点42.1℃,熔点-19.3℃,难溶于水,易溶于有机溶剂推测Ni(CO)4是_____...
- 下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白: 主族周期ⅠAⅡAⅢAⅣAⅤAⅥAⅦA0族2①②③3④⑤⑥⑦⑧4⑨⑩(1)元素⑩名称为...
- 下表是元素周期表的一部分,回答下列问题:(1)写出①---⑿号元素的元素符号①___ ②___ ③____ ④____ ⑤____ ⑥____ ⑦___ ⑧____ ⑨_...
- 向盛有I2水溶液的试管中,再加四氯化碳振荡,静置后观察到的现象是( )A.上层橙红色,下层接近无色B.均匀、透明、紫红色C....
- 下列各组物质,能用一种试剂鉴别的是( )A.苯、己烯、甲苯B.乙酸、乙醛、乙醇C.乙醛、溴乙烷、硝基苯D.苯酚、乙醇、甘油
- 除去下列物质中所含少量杂质(括号内为杂质),所选用的试剂和分离方法能达到实验目的的是( ) 混合物试剂分离方法A苯(苯酚)溴水...