本试题 “某研究性学习小组的同学拟分析某市空气的质量情况,测定该市空气中SO2的含量并制定下列研究方案:Ⅰ.已知:SO2与酸性KMnO4溶液(Mn2+在溶液中近无色)发生反...” 主要考查您对测定物质组成、成分含量
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 测定物质组成、成分含量
定量实验介绍:

燃烧法测定氨基酸的组成:
实验室用燃烧法测定某种氨基酸(CxHyOzNp)的分子组成。取Wg该种氨基酸放在纯氧中充分燃烧,生成CO2、H2O和N2。现按下图所示装置进行实验。

①实验开始时,首先要通入一段时间的氧气,目的是排除体系中的N2。
②D装置的作用是吸收未反应的O2,保证最终收集的气体是N2。
③读取N2体积时,应注意:量筒内液面与广口瓶中的液面相持平视线与凹液面最低处相切。
④实验中测得N2的体积为VmL(已折算为标准状况)。为确定此氨基酸的分子式,还需要的有关数据为生成二氧化碳气体的质量、生成水的质量、氨基酸的相对分子质量
用氨气还原氧化铜的方法测定铜的近似相对原子质量:
实验室用氨气还原氧化铜的方法测定铜的近似相对原子质量,反应的化学方程式为:2NH3+3CuO
 N2+3Cu+3H2O
N2+3Cu+3H2O(1)如果选用测定反应物CuO和生成物H2O的质量[m(CuO)、m(H2O)]时,请用下列仪器设计一个简单的实验方案。
装置图:
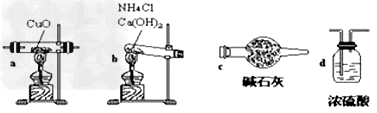
①连接顺序为:bcacd
②d中浓硫酸的作用是吸收未反应的氨、防止空气中水分进入;实验完毕时观察到a中的现象是固体由黑色转变为红色;
③Cu的相对原子质量的表达式
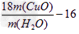
发现相似题
与“某研究性学习小组的同学拟分析某市空气的质量情况,测定该市...”考查相似的试题有:
- 我国生活饮用水水质标准规定锰元素不得超过0.1mg/L.水体中的锰主要以Mn2+存在,可通过放大反应法测定自来水中Mn2+的含量,根...
- 某化学兴趣小组为了探究在常温下某非金属氧化物形成的未知气体的成分.该小组成员将气体通入澄清石灰水,发现变浑浊,持续通...
- 实验事实:某研究性学习小组将一定浓度的Na2CO3 溶液滴入CuSO4溶液中,结果得到蓝色沉淀。I.甲同学认为:CuCO3是难溶解的物...
- 某校化学兴趣小组的同学欲测定某种品牌味精中食盐的含量.下面是该小组所做的有关实验步骤:①称取某品牌袋装味精样品10.0g放...
- 现有NaHCO3和Na2CO3•xH2O的混合物,为了测定x值,某同学设计了如下装置进行实验:(1)A处为加热NaHCO3和Na2CO3•xH2O混合物的...
- 物质的性质是由物质的组成和结构决定的。 乙二酸(HOOC-COOH)俗称草酸,其主要物理常数如下:注:表中“-”表示尚未有具体数据。...
- 用含少量铁的氧化铜制取氯化铜晶体(CuCl2·XH2O)。 有如下操作:已知:在pH为4~5时,Fe3+几乎完全水解而沉淀,而此时Cu2+却几...
- 某有机物燃烧后产物只有CO2和H2O,可推出的结论是,这种有机物中( )A.一定只有C、HB.可能含有C、H、OC.一定含有C、H、无...
- 在阅读资料时,小红发现,儿童从空气中吸入的铅量是成人吸入量的1.6~1.7倍.为了探讨这个现象,她展开了如下的研究.利用所...
- 有两种物质的量浓度相等的溶液,把它们等体积混合有白色沉淀生成,加入过量稀HNO3后,沉淀消失并放出气体,再加入AgNO3溶液又...