本试题 “下表是不同温度下水的离子积数据试回答以下问题(1)若25<t1<t2,则a________1×10-14(填“>”、“<”或“=”),作此判断的理由是________________________。(...” 主要考查您对水的电离平衡
溶液的酸碱性
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 水的电离平衡
- 溶液的酸碱性
水的电离:
水是一种极弱的电解质,可以发生微弱电离,电离方程式为:H2O H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L
H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L
注:水的电离是永恒存在的,不研究水溶液的体系中均存在水的电离平衡,不要忽略H+和OH-共同存在。
水是一种极弱的电解质,可以发生微弱电离,电离方程式为:H2O
 H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L
H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L 注:水的电离是永恒存在的,不研究水溶液的体系中均存在水的电离平衡,不要忽略H+和OH-共同存在。
溶液的酸碱性:
(1)pH=-lg[c(H+)],在溶液的c(H+)很小时,用pH来表示溶液的酸度。
(2)pH越大,c(H+)越小,c(OH-)越大,酸性越弱,碱性越强。pH越小,c(H+)越大,c(OH-)越小,酸性越强,碱性越弱。
(3)pH的范围:0~14
(4)溶液酸碱性判断:
当c(H+)>c(OH-)时,溶液呈酸性;
当c(H+)>=c(OH-)时,溶液呈键性;
当c(H+)<c(OH-)时,溶液呈中性。
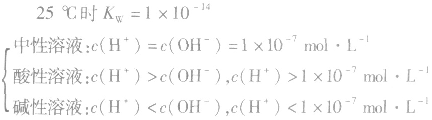
(5)关于pH相同的酸(含强酸和弱酸)
①溶液中c(H+)相等(填“相等”或“不等”)。
②溶液中溶质的物质的量的浓度:强酸<弱酸(填“>”或“<”)。
③耗碱规律:pH和溶液体积均相同的HCl、H2SO4、CH3COOH与碱完全反应时,消耗碱物质的量最多的是CH3COOH。
④稀释规律:分别加水稀释m倍时,溶液的物质的量的浓度均变为原来的1/m,强酸中c(H+)变为原来的1/m,但弱酸中c(H+)减小小于(填“大于”或“小于”)m倍,故稀释后弱酸酸性强于强酸。
(1)pH=-lg[c(H+)],在溶液的c(H+)很小时,用pH来表示溶液的酸度。
(2)pH越大,c(H+)越小,c(OH-)越大,酸性越弱,碱性越强。pH越小,c(H+)越大,c(OH-)越小,酸性越强,碱性越弱。
(3)pH的范围:0~14
(4)溶液酸碱性判断:
当c(H+)>c(OH-)时,溶液呈酸性;
当c(H+)>=c(OH-)时,溶液呈键性;
当c(H+)<c(OH-)时,溶液呈中性。
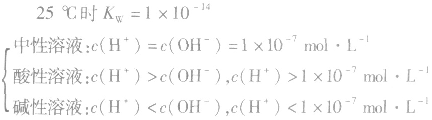
(5)关于pH相同的酸(含强酸和弱酸)
①溶液中c(H+)相等(填“相等”或“不等”)。
②溶液中溶质的物质的量的浓度:强酸<弱酸(填“>”或“<”)。
③耗碱规律:pH和溶液体积均相同的HCl、H2SO4、CH3COOH与碱完全反应时,消耗碱物质的量最多的是CH3COOH。
④稀释规律:分别加水稀释m倍时,溶液的物质的量的浓度均变为原来的1/m,强酸中c(H+)变为原来的1/m,但弱酸中c(H+)减小小于(填“大于”或“小于”)m倍,故稀释后弱酸酸性强于强酸。
溶液的pH:
1.定义:溶液里H+的物质的量浓度的负对数叫做pH。
2.表达式:
3.含义: pH越大,c(H+)越小,c(O-一)越大,酸性越弱,碱性越强。pH越小,c(H+)越大,c(OH-)越小,酸性越强,碱性越弱。
4.适用范围:
c(H+)很小时,用pH来表示溶液的酸碱度更方便。所以,pH适用于酸、碱的稀溶液
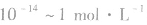 之间],pH取值范刚为0~14。
之间],pH取值范刚为0~14。
5.溶液的酸碱性和pH: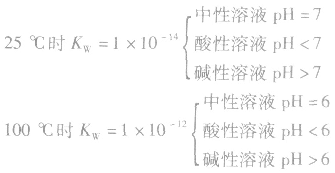
发现相似题
与“下表是不同温度下水的离子积数据试回答以下问题(1)若25<t1...”考查相似的试题有:
- 常温下,向一定体积的1mol.L-1的醋酸溶液中逐滴加入等浓度的氢氧化钠溶液,溶液中pOH和pH的变化如图所示,已知该条件下醋酸的...
- 下列有关溶液pH的说法正确的是( )A.将pH=11的氢氧化钠溶液加水稀释100倍,溶液中c(H+)=10-13mol/LB.将pH=9的氢氧化钠溶液和...
- 有浓度均为0.1 mol/L的①Na2CO3、②CH3COONa、:③NaOH三份溶液,下列说法正确的是A.溶液的pH:③>②>①B.水电离出的c(H+):②>①...
- 下列表达式中能精确计算任意浓度[c(NaOH)]的NaOH溶液中氢氧根离子的浓度[c(OH-)]的是(Kw表示水的离子积)( )A.c(OH-)=c(...
- 某二元酸(化学式用H2A表示)在水中的电离方程式为:H2A====H++HA- HA-H++A2- 在0.1mol·L-1Na2A溶液中存在的粒子,其浓度关系...
- 常温下,某溶液中由水电离的c(H+)=1×10-13mol•L-1,该溶液可能是( )①氯化铵水溶液②硝酸钠水溶液③硫酸水溶液④氢氧化钠水溶...
- 相同温度下,在水中分别加入下列物质,若用表示水的离子积,a表示水的电离度,能使的值增大的是A.NaOHB.C.HC1D.
- 甲溶液的pH=3,乙溶液的pH=1,则甲溶液中c(H+)与乙溶液中c(H+)之比[ ]A.100B.1/100C.3D.1/3
- 下列说法正确的是[ ]A.0.2mol·L-1的醋酸钠溶液中,c(Na+)=c(CH3COO-)B.室温下,pH=3盐酸和pH=11的氨水等体积混合后的溶液pH...
- 用0.01 mol·L-1H2SO4溶液滴定0.01 mol·L-1NaOH溶液,中和后加水至100 mL。若滴定时终点判断有误差:①若多加了1滴H2SO4②若少加...