本试题 “下列叙述不正确的是( )A.c(NH4+)相等的(NH4)2SO4溶液、NH4HSO4溶液和NH4Cl溶液中,溶质浓度大小关系是:c[(NH4)2SO4]<NH4HSO4]< c(NH4Cl)B.欲除去CuCl2...” 主要考查您对粒子浓度大小的比较
物质的除杂
溶液pH的有关计算
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 粒子浓度大小的比较
- 物质的除杂
- 溶液pH的有关计算
离子浓度大小比较方法:
(1)考虑水解因素:如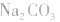 溶液
溶液 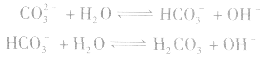
所以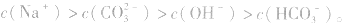
(2)不同溶液中同一离子浓度的比较要看溶液中其他离子对它的影响。如相同浓度的
 三种溶液中,
三种溶液中, 由大到小的顺序是c>a>b。
由大到小的顺序是c>a>b。
(3)混合液中各离子浓度的比较要综合分析水解因素、电离因素。如相同浓度的 的混合液中,离子浓度顺序为:
的混合液中,离子浓度顺序为: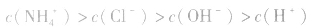
 的电离程度大于
的电离程度大于 的水解程度。
的水解程度。
盐溶液的“三大守恒”:
①电荷守恒:电解质溶液中所有阳离子所带有的正电荷数与所有的阴离子所带的负电荷数相等。如NaHCO3溶液中:
推出: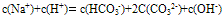
②物料守恒:电解质溶液中由于电离或水解因素,离子会发生变化变成其它离子或分子等,但离子或分子中某种特定元素的原子的总数是不会改变的。如NaHCO3溶液中nc(Na+):nc(C)=1:1,
推出: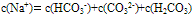
③质子守恒:电解质溶液中分子或离子得到或失去质子(H+)的物质的量应相等。例如在NH4HCO3溶液中H3O+、H2CO3为得到质子后的产物;NH3、OH-、CO32-为失去质子后的产物,故有以下关系: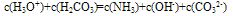
(2)粒子浓度大小比较的方法:
①单一溶液中离子浓度大小的比较
A. 一元弱酸盐溶液中离子浓度的关系是:
c(不水解离子)>c(水解离子)>c(显性离子)>c(水电离出的另一离子)
如:在CH3COONa溶液中各离子浓度大小关系: 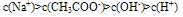
B. 二元弱酸盐溶液中离子浓度的关系是:
c(不水解离子)>c(水解离子)>c(显性离子)> c(二级水解离子)>c(水电离出的另一离子)
如:Na2CO3溶液中离子浓度的关系: 
②比较不同电解质溶液中同一种粒子浓度的大小。应注意弱酸、弱碱电离程度的大小以及影响电离度的因素,盐类水解及水解程度对该粒子浓度的影响。
③比较经过反应化学反应后离子浓度的大小:
A. 确定电解质溶液的成分
B. 确定溶液中含哪些粒子(分子、离子),此时要考虑物质的电离和水解情况
C. 确定各种粒子的浓度或物质的量的大小
D. 根据题目要求做出判断
注:要抓住“两小”。即弱电解质电离程度小,故未电离的弱电解质分子数远多于已电离出离子数目;盐的水解程度小,故未水解的粒子数目远多于水解生成的粒子数目
(1)不增:不增加新的杂质
(2)不减:被提纯的物质不能减少
(3)易分:操作简便,易于分离
气体除杂的原则:
(1)不引入新的杂质
(2)不减少被净化气体的量注意的问题:
①需净化的气体中含有多种杂质时,除杂顺序:一般先除去酸性气体,如:氯化氢气体,CO2、SO2等,水蒸气要在最后除去。
②除杂选用方法时要保证杂质完全除掉,如:除CO2最好用NaOH不用Ca(OH)2溶液,因为Ca(OH)2是微溶物,石灰水中Ca(OH)2浓度小,吸收CO2不易完全。
方法:
A. 杂质转化法:欲除去苯中的苯酚,可加入氢氧化钠,使苯酚转化为苯酚钠,利用苯酚钠易溶于水,使之与苯分开
B. 吸收洗涤法;欲除去二氧化碳中混有的少量氯化氢和水,可使混合气体先通过饱和碳酸氢钠溶液,再通过浓硫酸即可除去
C. 沉淀过滤法:欲除去硫酸亚铁溶液中混有的少量硫酸铜,加入少量铁粉,待充分反应后,过滤除去不溶物即可
D. 加热升华法:欲除去碘中的沙子,即可用此法
E. 溶液萃取法:欲除去水中含有的少量溴,可采用此法
F. 结晶和重结晶:欲除去硝酸钠溶液中少量的氯化钠,可利用二者的溶解度不同,降低溶液温度,使硝酸钠结晶析出,可得到纯硝酸钠晶体
G. 分馏蒸馏法:欲除去乙醚中少量的酒精,可采用多次蒸馏的方法
H. 分液法:欲将密度不同且又互不相溶的液体混合物分离,可采用此法,如将苯和水分离
K. 渗析法:欲除去胶体中的离子,可采用此法。如除去氢氧化钠胶体中的氯离子
常见物质除杂总结:
原物所含杂质除杂质试剂除杂质的方法
(1)N2(O2)-------灼热的铜丝网洗气
(2)CO2(H2S)-------硫酸铜溶液洗气
(3)CO(CO2)-------石灰水或烧碱液洗气
(4)CO2(HCl)-------饱和小苏打溶液洗气
(5)H2S(HCl)-------饱和NaHS溶液洗气
(6)SO2(HCl)-------饱和NaHSO3溶液洗气
(7)Cl2(HCl)-------饱和NaCl溶液洗气
(8)CO2(SO2)-------饱和小苏打溶液洗气
(9)碳粉(MnO2)-------浓盐酸加热后过滤
(10)MnO2(碳粉)-------加热灼烧
(11)碳粉(CuO)-------盐酸或硫酸过滤
(12)Al2O3(Fe2O3)-------NaOH溶液(过量),再通CO2过滤、加热固体
(13)Fe2O3(Al2O3)-------NaOH溶液过滤
(14)Al2O3(SiO2)-------盐酸NH3·H2O过滤、加热固体
(15)SiO2(ZnO)-------盐酸过滤
(16)CuO(ZnO)-------NaOH溶液过滤
(17)BaSO4(BaCO3)-------稀硫酸过滤
(18)NaOH(Na2CO3)-------Ba(OH)2溶液(适量)过滤
(19)NaHCO3(Na2CO3)-------通入过量CO2
(20)Na2CO3(NaHCO3)-------加热
(21)NaCl(NaHCO3)-------盐酸蒸发结晶
(22)NH4Cl[(NH4)2SO4]-------BaCl2溶液(适量)过滤
(23)FeCl3(FeCl2)-------通入过量Cl2
(24)FeCl3(CuCl2)-------铁粉、Cl2过滤
(25)FeCl2(FeCl3)-------铁粉过滤
(26)Fe(OH)3胶体(FeCl3)-------(半透膜)渗析
(27)CuS(FeS)-------稀盐酸或稀硫酸过滤
(28)I2(NaCl)------升华
(29)NaCl(NH4Cl)-------加热
(30)KNO3(NaCl)-------蒸馏水重结晶
(31)乙烯(SO2、H2O)碱石灰洗气
(32)乙烷(乙烯)-------溴水洗气
(33)溴苯(溴)-------稀NaOH溶液分液
(34)硝基苯(NO2)-------稀NaOH溶液分液
(35)甲苯(苯酚)-------NaOH溶液分液
(36)乙醛(乙酸)-------饱和Na2CO3溶液蒸馏
(37)乙醇(水)-------新制生石灰蒸馏
(38)苯酚(苯)-------NaOH溶液、CO2分液
(39)乙酸乙酯(乙酸)-------饱和Na2CO3溶液分液
(40)溴乙烷(乙醇)-------蒸馏水分液
(41)肥皂(甘油)-------食盐过滤
(42)葡萄糖(淀粉)-------(半透膜)渗析
溶液pH的计算方法:
总体原则
(1)若溶液为酸性,先求C(H+),再求pH;
(2)若溶液为碱性,先求C(OH-),再由 ,最后求pH。
,最后求pH。
1.单一溶液pH的计算
(1)强酸溶液,如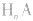 溶液,设溶质的物质的量浓度为
溶液,设溶质的物质的量浓度为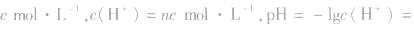
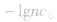
(2)强碱溶液,如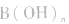 溶液,设溶质的物质的量浓度为
溶液,设溶质的物质的量浓度为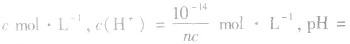
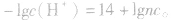
2.两强酸混合后pH的计算
由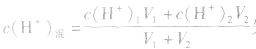 先求出混△后的
先求出混△后的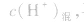 再根据公式
再根据公式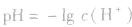 求pH。若两强酸溶液等体积混合,可采用速算方法:混合后溶液的pH等于混合前溶液pH小的加0.3。如pH=3和pH=5的盐酸等体积混合后,pH=3.3。
求pH。若两强酸溶液等体积混合,可采用速算方法:混合后溶液的pH等于混合前溶液pH小的加0.3。如pH=3和pH=5的盐酸等体积混合后,pH=3.3。
3.两强碱混合后pH的计算
由 先求出混台后的
先求出混台后的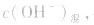 再通过
再通过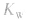 求出混合后的c(H+),最后求pH。若两强碱溶液等体积混合,可采用速算方法:混合后溶液的pH等于混合前溶液pH大的减0.3。如pH=9和pH=11的烧碱溶液等体积混合后, pH=10.7。
求出混合后的c(H+),最后求pH。若两强碱溶液等体积混合,可采用速算方法:混合后溶液的pH等于混合前溶液pH大的减0.3。如pH=9和pH=11的烧碱溶液等体积混合后, pH=10.7。
4.强酸与强碱混合后pH的计算
强酸与强碱混合的实质是中和反应即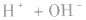
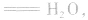 中和后溶液的pH有以下几种情况:
中和后溶液的pH有以下几种情况:
(1)若恰好中和,pH=7。
(2)若剩余酸,先求中和后的c(H+),再求pH。
(3)若剩余碱,先求中和后的c(OH-),再通过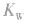 求出
求出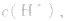 最后求pH.
最后求pH.
注意:强酸与强碱等体积混合后溶液酸碱性的判断规律:
①若二者pH之和为14,则混合后的溶液呈中性, pH=7
②若二者pH之和大于14,则混合后的溶液呈碱性
③若二者pH之和小于14,则混合后的溶液呈酸性,
5.溶液稀释后求pH
(1)对于强酸溶液,每稀释10倍体积,pH增大1 个单位;对于弱酸溶液,每稀释10倍体积,pH增大不足一个单位。无论稀释多少倍,酸溶液的pH不能等于或大于7,只能趋近于7。
(2)对于强碱溶液,每稀释10倍体积,pH减小1 个单位;对于弱碱溶液,每稀释10倍体积,pH减小不足一个单位。无论稀释多少倍,碱溶液的pH不能等于或小于7,只能趋近于7。
例如:pH=6的HCl溶液稀释100倍,溶液pH≈7 (不能大于7);
pH=8的NaOH溶液稀释100倍,溶液pH≈7(不能小于7):
pH=3的HCl溶液稀释100倍,溶液pH=5;
pH=10的NaOH溶液稀释100倍,溶液pH=8。
注意:弱酸、弱碱的稀释:在稀释过程中有浓度的变化,又有电离平衡的移动,不能求得具体数值,只能确定其pH范同。
例如:pH=3的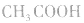 溶液稀释100倍,稀释后
溶液稀释100倍,稀释后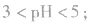
pH=10的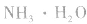 溶液稀释100倍,稀释后8<
溶液稀释100倍,稀释后8<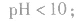
pH=3的酸溶液稀释100倍,稀释后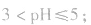
pH=10的碱溶液稀释100倍,稀释后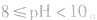
与“下列叙述不正确的是( )A.c(NH4+)相等的(NH4)2SO4溶液、NH4...”考查相似的试题有:
- 下列溶液中有关物质的量浓度关系和计算不正确的是[ ]A.pH相等的NaOH、CH3COONa和NaHCO3三种溶液,则有c(NaOH)c(H+)>c(H2A)> ...
- 下列有关各溶液的表述正确的是( ) A.0.1mol•L-1NH4Cl溶液中:c(NH4+)=c(Cl-) B.将稀硫酸滴入硝酸钠溶液得到的pH=5的...
- 有①氨水 ②NH4Cl溶液 ③Na2CO3溶液 ④NaHCO3溶液各25 mL,物质的量浓度均为0.1 mol/L,下列说法正确的是[ ]A.4种溶液pH的大小顺...
- 弱电解质的电离平衡、盐类的水解平衡和难溶物的溶液平衡均属于化学平衡。I、已知H2A在水中存在以下平衡:H2AH++HA-,HA-H...
- 常温下,下列溶液的PH或微粒的物质的量浓度关系不正确的是( ) A.PH=5.2的CH3COOH与CH3COONa混合溶液中,c(Na+)<CH3COO-...
- 实验室中下列除杂方法不正确的是( )A.乙酸乙酯中混有乙醇和乙酸,可加饱和Na2CO3溶液再分液除去B.溴苯中的溴可加NaOH溶液...
- 除去Na2CO3固体中少量NaHCO3的最佳方法是[ ]A.加入适量盐酸B.加入NaOH溶液C.加热D.配成溶液后通入CO2
- 下列实验能够达到实验目的是( )A.分离沸点相差较大的互溶液体混合物B.除去CO气体中得CO2气体C.电解饱和食盐水制氯气和氢...
- 用括号内试剂除去下列各物质中的少量杂质,不正确的是[ ]A.乙烯中的二氧化硫(氢氧化钠溶液)B.乙酸乙酯中的乙酸(饱和Na2C...
- 常温下,下列各组数据中比值为2:1的是( ) A.Na2CO3溶液中c(Na+)与c(CO32-)之比 B.0.2mol•L-1的CH3COOH溶液与0.1mol•...