本试题 “下列说法正确的是A.一定温度下,反应MgCl2(l)===Mg(l)+ Cl2(g)的ΔH>0 ΔS>0B.水解反应NH4++H2ONH3·H2O+H+达到平衡后,升高温度平衡逆向移动C.铅蓄电...” 主要考查您对焓变、反应热
熵;熵变
影响化学反应速率的因素
盐水解的影响因素
二次电池
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 焓变、反应热
- 熵;熵变
- 影响化学反应速率的因素
- 盐水解的影响因素
- 二次电池
反应热,焓变:
化学能可以转化为热能、电能和光能等,化学反应中的能量变化,通常主要表现为热量的变化。
1.定义:在化学反应过程中,当生成物和反应物具有相同温度时所放出或吸收的热量,通常叫做化学反应的反应热。在恒温、恒压条件下,化学反应过程中吸收或放出的热量称为反应的焓变。
2.符号:△Ⅳ
3.单位:kJ·mol-1
4.产生原因:化学反应过程中旧键断裂吸收的总能量与新键形成释放的总能量不相等,故化学反应均伴随着能量变化——吸热或放热。
5.表示方法:放热反应的△H<0,吸热反应的△H>0.
化学能可以转化为热能、电能和光能等,化学反应中的能量变化,通常主要表现为热量的变化。
1.定义:在化学反应过程中,当生成物和反应物具有相同温度时所放出或吸收的热量,通常叫做化学反应的反应热。在恒温、恒压条件下,化学反应过程中吸收或放出的热量称为反应的焓变。
2.符号:△Ⅳ
3.单位:kJ·mol-1
4.产生原因:化学反应过程中旧键断裂吸收的总能量与新键形成释放的总能量不相等,故化学反应均伴随着能量变化——吸热或放热。
5.表示方法:放热反应的△H<0,吸热反应的△H>0.
自发过程与自发反应:
在一定温度和压强下,无需外界帮助就能自动进行的过程叫做自发过程;在一定温度和压强下,无需外界帮助就可以自发进行到显著程度的化学反应叫自发反应。
化学反应方向的判据:
1.焓变对反应方向的影响:
△H<0 的化学反应也能自发进行。但有些△H>0的化学反应也能自发进行,也就是说,焓变是与化学反应能否自发进行有关的一个重要因素,但不是唯一的因素:
2.熵与熵变:
熵是用于描述体系混乱度的物理量,以符号S表示。熵值越大,体系的混乱度越大。
在一定条件下,不同物质的熵值不同;对同一物质来说,S(g)>S(l)>S(s),S(aq)>S(s)。
物质发生化学反应后熵值也发生变化,这个熵值的变化叫做反应的熵变,以符号△S表示,单位是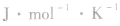 。
。
△S=生成物总熵一反应物总熵
若△S为正值,表示反应过程中熵值增大,称为熵增过程;若△S为负值,表示反应过程中熵值减小,称为熵减过程。在与外界隔离的体系中,自发过程将导致体系的熵值增大,这个原理也叫做熵增原理。
3.熵变对反应方向的影响:
△S>0有利于化学反应的自发进行,有些△S>0 的化学反应在常温下不能自发进行,但在较高温度下可以自发进行,有些△S<0的化学反应也能自发进行。总之,熵变是与化学反应能否自发进行有关的一个重要因素,但不是唯一的因素。
4.焓变与熵变对反应方向的共同影响:
在温度和压强一定的条件下,化学反应的方向是反应的焓变和熵变共同影响的结果,反应方向的判据是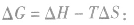
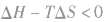 反应能自发进行
反应能自发进行
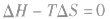 反应达到平衡状态
反应达到平衡状态
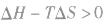 反应不能自发进行
反应不能自发进行
在一定温度和压强下,无需外界帮助就能自动进行的过程叫做自发过程;在一定温度和压强下,无需外界帮助就可以自发进行到显著程度的化学反应叫自发反应。
化学反应方向的判据:
1.焓变对反应方向的影响:
△H<0 的化学反应也能自发进行。但有些△H>0的化学反应也能自发进行,也就是说,焓变是与化学反应能否自发进行有关的一个重要因素,但不是唯一的因素:
2.熵与熵变:
熵是用于描述体系混乱度的物理量,以符号S表示。熵值越大,体系的混乱度越大。
在一定条件下,不同物质的熵值不同;对同一物质来说,S(g)>S(l)>S(s),S(aq)>S(s)。
物质发生化学反应后熵值也发生变化,这个熵值的变化叫做反应的熵变,以符号△S表示,单位是
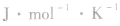 。
。△S=生成物总熵一反应物总熵
若△S为正值,表示反应过程中熵值增大,称为熵增过程;若△S为负值,表示反应过程中熵值减小,称为熵减过程。在与外界隔离的体系中,自发过程将导致体系的熵值增大,这个原理也叫做熵增原理。
3.熵变对反应方向的影响:
△S>0有利于化学反应的自发进行,有些△S>0 的化学反应在常温下不能自发进行,但在较高温度下可以自发进行,有些△S<0的化学反应也能自发进行。总之,熵变是与化学反应能否自发进行有关的一个重要因素,但不是唯一的因素。
4.焓变与熵变对反应方向的共同影响:
在温度和压强一定的条件下,化学反应的方向是反应的焓变和熵变共同影响的结果,反应方向的判据是
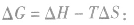
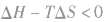 反应能自发进行
反应能自发进行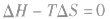 反应达到平衡状态
反应达到平衡状态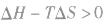 反应不能自发进行
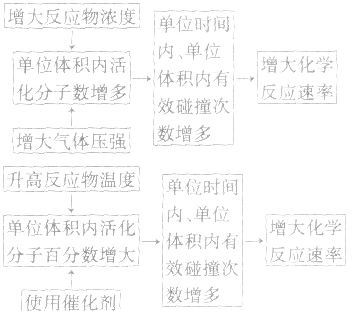
反应不能自发进行影响化学反应速率的因素:
1.内因:参加反应的物质的结构及性质。
2.外因:主要是指浓度、温度、压强和催化剂,另外还有光、超声波、激光、搅拌、固体表面积、形成原电池等。
(1)浓度:其他条件相同时,增大反应物浓度,化学反应速率增大;减小反应物浓度,化学反应速率减小。在一定温度下,同体、纯液体的浓度视为定值,如C与CO2的反应、Na与H2O的反应中,C的量和Na、H2O 的量减少并不意味着其“浓度”减小,即不冈其量的增减而影响反应速率,但会因固体表面积的变化而改变反应速率。
(2)温度:其他条件相同时,升高温度,可以加快反应速率,实验测得,温度每升高10℃,化学反应速率通常增大到原来的2~4倍。
经验公式为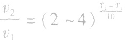
(3)压强:对于气体反应,当温度不变时,增大压强可以加快反应速率。对于气体反应体系,压强改变时有以下几种情况:

(4)催化剂:催化剂是能改变化学反应速率但在反应前后本身的质量和化学性质都不变的物质。对于某些化学反应,使用正催化剂能显著加快化学反应速率。
(5)其他因素:增大同体的表面积(如将块状改为粉末状),可增大反应速率;光照一般也可增大某些反应的速率;形成原电池可以加快反应速率;此外,超声波、放射线、电磁波等因素也能影响反应速率。
3.外因对化学反应速率影响的微观解释
1.内因:参加反应的物质的结构及性质。
2.外因:主要是指浓度、温度、压强和催化剂,另外还有光、超声波、激光、搅拌、固体表面积、形成原电池等。
(1)浓度:其他条件相同时,增大反应物浓度,化学反应速率增大;减小反应物浓度,化学反应速率减小。在一定温度下,同体、纯液体的浓度视为定值,如C与CO2的反应、Na与H2O的反应中,C的量和Na、H2O 的量减少并不意味着其“浓度”减小,即不冈其量的增减而影响反应速率,但会因固体表面积的变化而改变反应速率。
(2)温度:其他条件相同时,升高温度,可以加快反应速率,实验测得,温度每升高10℃,化学反应速率通常增大到原来的2~4倍。
经验公式为
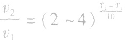
(3)压强:对于气体反应,当温度不变时,增大压强可以加快反应速率。对于气体反应体系,压强改变时有以下几种情况:

(4)催化剂:催化剂是能改变化学反应速率但在反应前后本身的质量和化学性质都不变的物质。对于某些化学反应,使用正催化剂能显著加快化学反应速率。
(5)其他因素:增大同体的表面积(如将块状改为粉末状),可增大反应速率;光照一般也可增大某些反应的速率;形成原电池可以加快反应速率;此外,超声波、放射线、电磁波等因素也能影响反应速率。
3.外因对化学反应速率影响的微观解释

影响盐类水解平衡的因素:
主要因素是盐本身的性质,组成的盐的酸根对应的酸越弱(或阳离子对应的碱越弱),水解程度就越大,另外还受温度、浓度及外加酸碱等因素的影响。
(1)温度:盐的水解是吸热反应,因此升高温度水解程度增大;
(2)浓度:盐的浓度越小,水解程度越大,但溶液的酸碱性一般越弱;
(3)外加酸碱:外加酸碱能促进或抑制盐的水解,使盐的水解程度降低,但由于酸(或碱)的加入,使溶液的酸(碱性)增强。
例如: 外界条件对 水解平衡
水解平衡
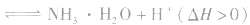 的影响
的影响
(4)能水解的阳离子与能水解的阴离子混合,会相互促进水解。常见的含下列离子的两种盐混合时,会发生较彻底的双水解反应:阳离子:Fe3+、Al3+;阴离子:CO32-、HCO3-、S2-、HS-、AlO2-、SO32-、HSO3-等。
(5)Fe3+与S2-、HS-、SO32-、HSO3-等还原性离子发生氧化还原反应,而不是发生双水解反应。
(6)HCO3-与AlO2-在溶液中也不能共存,可发生反应产生白色沉淀,但不是由于双水解反应,而是:
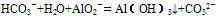
主要因素是盐本身的性质,组成的盐的酸根对应的酸越弱(或阳离子对应的碱越弱),水解程度就越大,另外还受温度、浓度及外加酸碱等因素的影响。
(1)温度:盐的水解是吸热反应,因此升高温度水解程度增大;
(2)浓度:盐的浓度越小,水解程度越大,但溶液的酸碱性一般越弱;
(3)外加酸碱:外加酸碱能促进或抑制盐的水解,使盐的水解程度降低,但由于酸(或碱)的加入,使溶液的酸(碱性)增强。
例如: 外界条件对
 水解平衡
水解平衡
 的影响
的影响
(4)能水解的阳离子与能水解的阴离子混合,会相互促进水解。常见的含下列离子的两种盐混合时,会发生较彻底的双水解反应:阳离子:Fe3+、Al3+;阴离子:CO32-、HCO3-、S2-、HS-、AlO2-、SO32-、HSO3-等。
(5)Fe3+与S2-、HS-、SO32-、HSO3-等还原性离子发生氧化还原反应,而不是发生双水解反应。
(6)HCO3-与AlO2-在溶液中也不能共存,可发生反应产生白色沉淀,但不是由于双水解反应,而是:
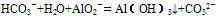
盐类水解程度大小比较规律:
1.盐水解生成的弱酸(或弱碱)越弱,水解程度越大。常据此判断弱酸(或弱碱)的相对强弱:如等浓度的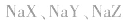 三种盐溶液,pH依次增大,则弱酸根离子
三种盐溶液,pH依次增大,则弱酸根离子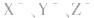 的水解程度依次增大,所以酸性HX>HY>HZ。
的水解程度依次增大,所以酸性HX>HY>HZ。
2.相同条件下:正盐>相应酸式盐。如水解程度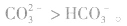
3.相互促进水解的盐>单水解的盐>相互抑制水解的盐。如水解程度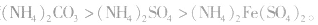
二次电池:
(1)蓄电池:蓄电池是可以反复使用、放电后可以充电使活性物质复原、以便再重新放电的电池,也称二次电池。其广泛用于汽车、发电站、火箭等部门。由所用电解质的酸碱性质不同分为酸性蓄电池和碱性蓄电池。
①酸性铅蓄电池铅蓄电池由一组充满海绵状金属铅的铅锑合金格板做负极,由另一组充满二氧化铝的铅锑合金格板做正极,两组格板相间浸泡在电解质稀硫酸中,放电时,电极反应为:
负极:Pb+SO42-=PbSO4+2e- 正极:PbO2+SO42-十4H++2e-=PbSO4+2H2O
总反应:Pb+PbO2+2H2SO4=2PbSO4十2H2O
放电后,正负极板上都沉积有一层PbSO4,放电到一定程度之后又必须进行充电,充电时用一个电压略高于蓄电池电压的直流电源与蓄电池相接,将负极上的PbSO4还原成Pb,而将正极上的PbSO4氧化成PbO2,
充电时发生放电时的逆反应:阴极:PbSO4+2e-=Pb+SO42-阳极:PbSO4+2H2O=PbO2+SO42-+4H++2e- 总反应:2PbSO4+2H2O=Pb+PbO2+H2SO4
②碱性蓄电池日常生活中用的充电电池就属于这类。它的体积、电压都和干电池差不多,携带方便,使用寿命比铅蓄电池长得多,使用信当可以反复充放电上千次,但价格比较贵。商品电池中有镍-镉(Ni-Cd)和镍一铁(Ni-Fe)两类,它们的电池反应是:
Cd+2NiO(OH)+2H2O 2Ni(OH)2+Cd(OH)2
2Ni(OH)2+Cd(OH)2
Fe+2NaO(OH)+2H2O 2Ni(OH)2+Fe(OH)2
2Ni(OH)2+Fe(OH)2
反应是在碱性条件下进行的,所以叫碱性蓄电池。
(2)银锌蓄电池 银锌电池是一种高能电池,它质量轻、体积小,是人造卫星、宇宙火箭、空间电视转播站等的电源。目前,有一种类似干电池的充电电池,它实际是一种银锌蓄电池,电解液为KOH溶液。 常见的钮扣电池也是银锌电池,它用不锈钢制成一个由正极壳和负极盖组成的小圆盒,盒内靠正极盒一端充由Ag2O和少量石墨组成的正极活性材料,负极盖一端填充锌汞合金作负极活性材料,电解质溶液为KOH浓溶液,溶液两边用羧甲基纤维素作隔膜,将电极与电解质溶液隔开。
负极:Zn+2OH--2e-=Zn(OH)2
正极:Ag2O+H2O+2e-=2Ag+2OH-?
银锌电池跟铅蓄电池一样,在使用一段时间后就要充电,充电过程表示如下:
阳极:2Ag+2OH--2e-=Ag2O+H2O
阴极:Zn(OH)2+2e-=Zn+2OH-?
总反应式:Zn+Ag2O+H2O Zn(OH)2+2Ag
Zn(OH)2+2Ag
一粒钮扣电池的电压达1.59V,安装在电子表里可使用两年之久。
(1)蓄电池:蓄电池是可以反复使用、放电后可以充电使活性物质复原、以便再重新放电的电池,也称二次电池。其广泛用于汽车、发电站、火箭等部门。由所用电解质的酸碱性质不同分为酸性蓄电池和碱性蓄电池。
①酸性铅蓄电池铅蓄电池由一组充满海绵状金属铅的铅锑合金格板做负极,由另一组充满二氧化铝的铅锑合金格板做正极,两组格板相间浸泡在电解质稀硫酸中,放电时,电极反应为:
负极:Pb+SO42-=PbSO4+2e- 正极:PbO2+SO42-十4H++2e-=PbSO4+2H2O
总反应:Pb+PbO2+2H2SO4=2PbSO4十2H2O
放电后,正负极板上都沉积有一层PbSO4,放电到一定程度之后又必须进行充电,充电时用一个电压略高于蓄电池电压的直流电源与蓄电池相接,将负极上的PbSO4还原成Pb,而将正极上的PbSO4氧化成PbO2,
充电时发生放电时的逆反应:阴极:PbSO4+2e-=Pb+SO42-阳极:PbSO4+2H2O=PbO2+SO42-+4H++2e- 总反应:2PbSO4+2H2O=Pb+PbO2+H2SO4
②碱性蓄电池日常生活中用的充电电池就属于这类。它的体积、电压都和干电池差不多,携带方便,使用寿命比铅蓄电池长得多,使用信当可以反复充放电上千次,但价格比较贵。商品电池中有镍-镉(Ni-Cd)和镍一铁(Ni-Fe)两类,它们的电池反应是:
Cd+2NiO(OH)+2H2O
 2Ni(OH)2+Cd(OH)2
2Ni(OH)2+Cd(OH)2 Fe+2NaO(OH)+2H2O
 2Ni(OH)2+Fe(OH)2
2Ni(OH)2+Fe(OH)2 反应是在碱性条件下进行的,所以叫碱性蓄电池。
(2)银锌蓄电池 银锌电池是一种高能电池,它质量轻、体积小,是人造卫星、宇宙火箭、空间电视转播站等的电源。目前,有一种类似干电池的充电电池,它实际是一种银锌蓄电池,电解液为KOH溶液。 常见的钮扣电池也是银锌电池,它用不锈钢制成一个由正极壳和负极盖组成的小圆盒,盒内靠正极盒一端充由Ag2O和少量石墨组成的正极活性材料,负极盖一端填充锌汞合金作负极活性材料,电解质溶液为KOH浓溶液,溶液两边用羧甲基纤维素作隔膜,将电极与电解质溶液隔开。
负极:Zn+2OH--2e-=Zn(OH)2
正极:Ag2O+H2O+2e-=2Ag+2OH-?
银锌电池跟铅蓄电池一样,在使用一段时间后就要充电,充电过程表示如下:
阳极:2Ag+2OH--2e-=Ag2O+H2O
阴极:Zn(OH)2+2e-=Zn+2OH-?
总反应式:Zn+Ag2O+H2O
 Zn(OH)2+2Ag
Zn(OH)2+2Ag 一粒钮扣电池的电压达1.59V,安装在电子表里可使用两年之久。
发现相似题
与“下列说法正确的是A.一定温度下,反应MgCl2(l)===Mg(l)+ Cl2...”考查相似的试题有:
- 白磷与氧可发生如下反应:P4+5O2= P4O10。已知断裂下列化学键需要吸收的能量分别为: P-P:a kJ·mol-1、P-O:b kJ·mol-1、P...
- 在一定条件下,当64gSO2气体被氧化成SO3气体时,共放出热量98.3KJ,已知SO2在此条件下转化率为80%,据此,下列热化学方程式...
- 磷在自然界常以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物有着广泛的应用。(1)红磷P(s)和Cl2(g)发生反应生...
- 下列说法中正确的是( )A.将等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多B.由“C(石墨)→C(金刚石);△H=+119KJ•mo...
- 碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期...
- 一定条件下,可逆反应C(s)+CO2(g) 2CO(g) ΔH>0,达到平衡状态,现进行如下操作:①升高反应体系的温度;②增加反应物C的用量...
- 一定温度下在体积为5 L的密闭容器中发生可逆反应。(Ⅰ)若某可逆反应的化学平衡常数表达式为:(1)写出该反应的化学方程式:__...
- 乙醇是重要的化工原料和液体燃料,可以利用下列反应制取乙醇:2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g)(1)写出该反应的...
- 化学电池在通迅、交通及日常生活中有着广泛的应用。(1)上图是锌锰干电池的基本构造图。①MnO2的作用是除去正极上的产物H2,...
- 铅酸蓄电池是目前应用普遍的化学电池,新型液流式铅酸蓄电池以可溶的甲基磺酸铅为电解质,电池总反应:Pb+PbO2+4H+2Pb2++2H2O...