本试题 “下列实验方案合理的是( )A.蒸干FeCl3溶液得到FeCl3固体B.用催化加氢的方法除去乙烷中的乙烯C.向淀粉碘化钾溶液中滴加氯水,溶液变为蓝色,说明Cl2的氧化...” 主要考查您对盐类水解判断溶液酸碱性或比较溶液pH值的大小
乙烯的制取
实验操作达到的预期目的
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 盐类水解判断溶液酸碱性或比较溶液pH值的大小
- 乙烯的制取
- 实验操作达到的预期目的
(1)盐水解的规律:
①谁弱谁水解,谁强显谁性,越弱越水解,都弱都水解,无弱不水解
②多元弱酸根、正酸根离子比酸式酸根离子水解程度大得多,故可只考虑第一步水解
(2)具体分析一下几种情况:
①强碱弱酸的正盐:弱酸的阴离子发生水解,水解显碱性;如:Na2CO3、NaAc等
②强酸弱碱的正盐:弱碱的阳离子发生水解,水解显酸性;如:NH4Cl、FeCl3、CuCl2等;
③强酸强碱的正盐,不发生水解;如:Na2SO4、NaCl、KNO3等;
④弱酸弱碱的正盐:弱酸的阴离子和弱碱的阳离子都发生水解,溶液的酸碱性取决于弱酸和弱碱的相对强弱,谁强显谁性;
⑤强酸的酸式盐只电离不水解,溶液显酸性,如:NaHSO4;而弱酸的酸式盐,既电离又水解,此时必须考虑其电离和水解程度的相对大小:若电离程度大于水解程度,则溶液显酸性,如:NaHSO3、NaH2PO4;若水解程度大于电离程度,则溶液显碱性,如:NaHCO3、NaHS、Na2HPO4等。
(3)几种盐溶液pH大小的比较强酸强碱盐pH=7、强碱弱酸盐pH>7、强酸弱碱盐pH<7
根据其相应的酸的酸性大小来比较,盐溶液对应的酸的酸性越强,其盐溶液的pH越小如:HClO酸性小于H2CO3,溶液pH NaClO>Na2CO3
酸式盐溶液酸碱性的判断:
酸式盐的水溶液显什么性,要看该盐的组成微粒。
1.强酸的酸式盐只电离,不水解,溶液一定显酸性。如 溶液:
溶液: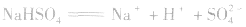
2.弱酸的酸式盐溶液的酸碱性,取决于酸式酸根离子的电离程度和水解程度的相对大小。
(1)若电离程度小于水解程度,溶液显碱性。例如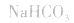 溶液中:
溶液中: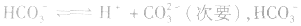
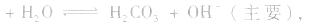
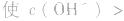
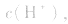 溶液显碱性。NaHS溶液、Na2HPO4溶液亦显碱性
溶液显碱性。NaHS溶液、Na2HPO4溶液亦显碱性
(2)若电离程度大于水解程度,溶液显酸性。例如 溶液中:
溶液中: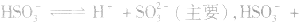
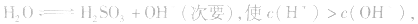 溶液显酸性
溶液显酸性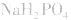 溶液亦显酸性。
溶液亦显酸性。
盐溶液蒸干后所得物质的判断:
1.考虑盐是否分解。如加热蒸干 溶液,因
溶液,因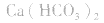 分解,所得固体应是
分解,所得固体应是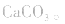
2.考虑氧化还原反应。如加热蒸干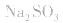 溶液,因
溶液,因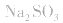 易被氧化,所得固体应是
易被氧化,所得固体应是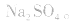
3.盐水解生成挥发性酸时,蒸干后一般得到弱碱,如蒸干 溶液,得
溶液,得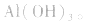 盐水解生成不挥发性酸时,蒸干后一般仍为原物质,如蒸干
盐水解生成不挥发性酸时,蒸干后一般仍为原物质,如蒸干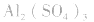 溶液,得
溶液,得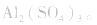
4.盐水解生成强碱时,蒸干后一般得到原物质,如蒸干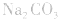 溶液,得到
溶液,得到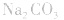 等。
等。
5.有时要多方面考虑,如加热蒸干 溶液时,既要考虑水解,又要考虑
溶液时,既要考虑水解,又要考虑 的分解,所得固体为
的分解,所得固体为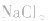
乙烯的制取:
(1)实验室里是把酒精和浓硫酸按1:3混合迅速加热到170℃,使酒精分解制得。浓硫酸在反应过程里起催化剂和脱水剂的作用。
制取乙烯的反应属于液--液加热型
C2H6O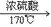 CH2=CH2↑+H2O
CH2=CH2↑+H2O
(2)装置图: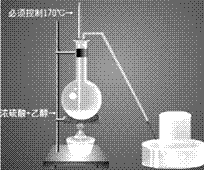
(3) 注意事项:
①酒精和浓硫酸按体积1比3混和,使乙醇利用率提高,必须使用无水酒精,而且必须控制170摄氏度才能制得乙烯。装置连接时由下至上,由左至右。温度计插入液面下。
②烧瓶内加沸石以避免暴沸。
③温度计水银头插入液面下,但不要接触烧瓶底部,以测定液体温度。
④要使液面温度迅速升到170摄氏度,以避免副反应发生。
(4)收集方法:乙烯的密度与空气相当,所以不能用排空气取气法,只能用排水法收集。
检验:点燃时火焰明亮,冒黑烟,产物为水和CO2;通入酸性高锰酸钾溶液中,紫色高锰酸钾褪色。
(5)实验现象:生成无色气体,烧瓶内液体颜色逐渐加深。
(6)两点说明
①实验室中用无水乙醇和浓硫酸制取乙烯气体,加热不久圆底烧瓶内的液体容易变黑,原因是:浓硫酸将无水乙醇氧化生成碳单质等多种物质,碳单质使烧瓶内的液体带上了黑色。制得的C2H4中往往混有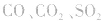 等气体。
等气体。
②实验时要求使反应温度迅速卜升到170℃并稳定在170℃左右,因该温度下主要产物是乙烯和水,而在140℃时主要产物是乙醚和水,当温度高于170℃ 时,乙醇和浓硫酸发生的氧化反应更加突出,反应产物有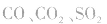 等多种物质。相关反应方程式为:
等多种物质。相关反应方程式为: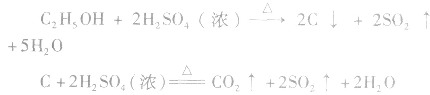
(1)①用托盘天平称取5.6g氧化铜粉末(托盘天平能准确到0.1克,所以用托盘天平称取5.6g氧化铜粉末是可以的)
②用10mL水和10mL酒精配制成20mL酒精溶液(由于分子间有间隔,10mL水和10mL静静混合后体积,不能配制成20mL酒精溶液)
③用排水集气法可收集到比较纯净的氧气(收集到的气体要比排空气法收集到的气体纯,由于空气的密度与氧气的密度相差不是很大,所以排空气法收集到的气体氧气不是很纯)
④用10mL量筒量取8.2mL水(10mL量筒精确到0.1mL,所以能量取8.2mL水)
(2) ①分别加入饱和碳酸钠溶液,鉴别乙酸乙酯和乙酸(观察到有气泡产生的是乙酸,能到到鉴别的目的)
②分别加入少量金属钠,比较水和乙醇中羟基氢的活泼性(通过观察与金属钠反应的剧烈程度可以判断羟基的活泼性,能达到目的)
③分别加入浓硝酸,比较铁和铜的金属活动性(铁和铜都能和浓硝酸反应,不能达到比较金属活动性的目的)
与“下列实验方案合理的是( )A.蒸干FeCl3溶液得到FeCl3固体B....”考查相似的试题有:
- 下列溶液中有关物质的量浓度关系正确的是( )A.在0.1mol/L的Na2S溶液中:c(OH―)= c(H+)+ c(HS-)+ c(H2S)B.pH相等的CH3CO...
- 25℃时,几种弱酸的电离常数如下,25℃时,下列说法正确的是[ ]A.等物质的量浓度的各溶液pH关系为:pH(CH3COONa)> pH(Na2S) > ...
- 25℃,在浓度为0.1mol/L的Na2CO3、NaHCO3、(NH4)2CO3、H2CO3溶液中,测得c(CO 2-3)分别为a、b、c、d(单位为mol/L)下列判...
- 下列溶液中微粒的物质的量浓度关系正确的是( )A.室温下,向0.01 mol·L-1NH4HSO4溶液中滴加NaOH溶液至中性:C(Na+)+C(H+)+C...
- 下列过程或现象与盐类水解无关的是A.向Na2CO3溶液中滴加酚酞试液变红色B.实验室保存硫酸亚铁溶液时加入少量铁粉C.加热FeCl...
- (8分)某同学应用如下所示装置研究物质的性质。其中气体m的主要成分是氯气,还含有少量空气和水蒸气。请回答下列问题:(1)...
- 氢溴酸在医药和石化工业上有广泛用途。下图是模拟工业制备氢溴酸粗产品并精制的流程:根据上述流程回答下列问题:(1)混合①中...
- 不能用排空气法收集的气体是A.H2B.CO2C.NOD.O2
- (12分)下图为学生设计的制取溴苯的装置。(1)图中的错误之处有 处。(2)往烧瓶中依次加入铁粉、苯和 。(3)与烧瓶中连接...
- (Ⅰ)用质量分数为98%的浓硫酸(密度为1.84g/cm3)配制成1mol/L的稀硫酸.现实验室仅需要这种硫酸220mL.试回答下列问题:(1)配...