本试题 “测血钙的含量时,可将2.0 mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀。将沉淀用稀硫酸处理得H2C2O4后,再用酸性KMnO4溶...” 主要考查您对氧化还原反应的滴定
氧化还原反应的计算
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 氧化还原反应的滴定
- 氧化还原反应的计算
氧化还原滴定法:
1.特点:氧化还原滴定法在药物分析中应用广泛,用于测定具有氧化性和还原性的物质,对不具有氧化性或还原性的物质,可进行间接测定。氧化还原反应较复杂,常伴有各种副反应,反应速度较慢,因此,氧化还原滴定法要注意选择合适条件使反应能定量、迅速、完全进行。
2.反应条件:
(1)滴定反应必须按一定的化学反应式定量反应,且反应完全,无副反应。
(2)反应速度必须足够快。
(3)必须有适当的方法确定化学计量点。
3.若氧化还原反应的速度极慢,该反应就不能直接用于滴定。通常采用提高氧化还原反应速度的方法主要有以下几点。
(1)增大反应物的浓度
(2)升高温度
(3)通过催化作用
4.氧化还原滴定法终点的判断
(1)自身指示剂如KMnO4滴定H2C2O4时,KMnO4既是标准溶液又是指示剂。
(2)特殊指示剂如用于碘量法中的淀粉溶液,本身不参与氧化还原反应,但它能与氧化剂作用产生特殊的颜色,因而可指示终点。
(3)氧化还原指示剂
5.高锰酸钾法
(1)基本原理和条件高锰酸钾法是以具有强氧化能力的高锰酸钾做标准溶液,利用其氧化还原滴定原理来测定其他物质的滴定分析方法。强酸性溶液中 MnO4-+8H++5e-→Mn2++4H2O
注意:但酸度太高时,会导致高锰酸钾分解,因此酸度控制常用3mol/L的H2SO4来调节,而不用HNO3或HCl来控制酸度。因为硝酸具有氧化性会与被测物反应;而盐酸具有还原性能与KMnO4反应。
(2)测定方法:
①直接滴定法由于高锰酸钾氧化能力强,滴定时无需另加指示剂,可直接滴定具有还原性的物质。
②返滴定法可测定一些不能直接滴定的氧化性和还原性物质。
③间接滴定法有些非氧化性或还原性物质不能用直接滴定法或返滴定法测定时,可采用此法。
(3)标准溶液的配制与标定
①高锰酸钾溶液的配制市售KMnO4试剂常含有杂质,而且在光、热等条件下不稳定,会分解变质。因此高锰酸钾标准溶液不能直接配制使用,通常先配成浓溶液放置储存,需要时再取适量稀释成近似浓度的溶液,然后标定使用。
②高锰酸钾溶液的标定常用于标定KMnO4的基准物是Na2C2O4。Na2C2O4在105℃~110℃烘干2h,放入干燥器中冷却后,即可使用。已标定过的KMnO4溶液在使用一段时间后必须重新标定。标定反应为:2MnO4-+5C2O42-+16H+==2Mn2++10CO2↑+8H2O
(4)标定时注意事项:
①滴定速度:开始时因反应速度慢,滴定速度要慢;开始后反应本身所产生的Mn2+起催化作用,加快反应进行,滴定速度可加快。
②温度:近终点时加热至65℃,促使反应完全
③酸度:保持一定的酸度(3mol/LH2SO4)。
④滴定终点:滴入微过量高锰酸钾,利用自身的粉红色指示终点(30秒不褪色)。
6.碘量法
(1)基本原理碘量法是利用碘的氧化性、碘离子的还原性进行物质含量测定的方法。I2是较弱的氧化剂;I-是中等强度的还原剂。碘量法可用直接测定和间接测定两种方式进行。
(2)①直接碘量法(或碘滴定法)直接碘量法是直接用I2标准溶液滴定还原性物质,又叫做碘滴定法。直接碘量法只能在酸性、中性或弱碱性溶液中进行。直接碘量法可用淀粉指示剂指示终点。直接碘量法还可利用碘自身的颜色指示终点,化学计量点后,溶液中稍过量的碘显黄色而指示终点。
②间接碘量法(或滴定碘法)对氧化性物质,可在一定条件下,用I-还原,产生I2,然后用Na2S2O3标准溶液滴定释放出的I2。这种方法就叫做间接碘量法或滴定碘法。间接碘量法也是使用淀粉溶液作指示剂,溶液由蓝色变无色为终点。
③间接碘量法的反应条件和滴定条件
A. 酸度的影响:I2与Na2S2O3应在中性、弱酸性溶液中进行反应。
B. 防止I2挥发的方法:在滴定前,加入过量KI(比理论值大2~3倍),减少I2挥发。
C. 防止I-被氧化
(3)标准溶液的配制和标定
①碘标准溶液(0.05mol/L)的配制和标定
A. 配制由于碘具有挥发性和腐蚀性,通常情况下,碘标准溶液是采用间接法配制。配制0.05mol/L时,可取碘13g,加碘化钾36g与水50ml溶解后,加稀盐酸3滴与水适量稀释至1000ml,摇匀,贮存于棕色试剂瓶中备用。
B. 标定:用三氧化二砷(As2O3)为基准物质,甲基橙为指示剂,用待标定的碘标准溶液滴定至终点。
②硫代硫酸钠标准溶液(0.1mol/L)的配制和标定
A. 配制:Na2S2O3溶液采取间接法配制。操作步骤:称取硫代硫酸钠26g与无水碳酸钠0.2g,加新煮沸过的冷水适量稀释至1000ml,摇匀,放置8~10天,滤过,备用。
在Na2S2O3溶液的配制过程中应采取下列措施:
第一、为了除去水中的微生物,用新煮沸冷却后的蒸馏水配制。
第二、配制时加入少量的Na2CO3,使溶液呈弱碱性,可减少溶解在水中的CO2、O2和杀死微生物。
第三、将配制溶液置于棕色瓶中,放置8~10天,待其浓度稳定后再标定,但若发现溶液浑浊,需重新配制。
B. 标定:以K2Cr2O7为基准物,加入碘化钾置换出定量的碘,再用硫代硫酸钠标准溶液滴定碘
标定方法为:精密称取在120℃干燥至恒重的基准物质重铬酸钾0.15g,置碘量瓶中,加水50ml溶解,加碘化钾2.0g,轻轻振摇,加稀硫酸40ml,摇匀,密塞,水封后在暗处放置10分钟,取出加水50ml稀释,用待标定Na2S2O3溶液滴定至近终点时,加淀粉指示剂3ml,继续滴定至溶液由蓝色变亮绿色为终点。
滴定反应为:

1.特点:氧化还原滴定法在药物分析中应用广泛,用于测定具有氧化性和还原性的物质,对不具有氧化性或还原性的物质,可进行间接测定。氧化还原反应较复杂,常伴有各种副反应,反应速度较慢,因此,氧化还原滴定法要注意选择合适条件使反应能定量、迅速、完全进行。
2.反应条件:
(1)滴定反应必须按一定的化学反应式定量反应,且反应完全,无副反应。
(2)反应速度必须足够快。
(3)必须有适当的方法确定化学计量点。
3.若氧化还原反应的速度极慢,该反应就不能直接用于滴定。通常采用提高氧化还原反应速度的方法主要有以下几点。
(1)增大反应物的浓度
(2)升高温度
(3)通过催化作用
4.氧化还原滴定法终点的判断
(1)自身指示剂如KMnO4滴定H2C2O4时,KMnO4既是标准溶液又是指示剂。
(2)特殊指示剂如用于碘量法中的淀粉溶液,本身不参与氧化还原反应,但它能与氧化剂作用产生特殊的颜色,因而可指示终点。
(3)氧化还原指示剂
5.高锰酸钾法
(1)基本原理和条件高锰酸钾法是以具有强氧化能力的高锰酸钾做标准溶液,利用其氧化还原滴定原理来测定其他物质的滴定分析方法。强酸性溶液中 MnO4-+8H++5e-→Mn2++4H2O
注意:但酸度太高时,会导致高锰酸钾分解,因此酸度控制常用3mol/L的H2SO4来调节,而不用HNO3或HCl来控制酸度。因为硝酸具有氧化性会与被测物反应;而盐酸具有还原性能与KMnO4反应。
(2)测定方法:
①直接滴定法由于高锰酸钾氧化能力强,滴定时无需另加指示剂,可直接滴定具有还原性的物质。
②返滴定法可测定一些不能直接滴定的氧化性和还原性物质。
③间接滴定法有些非氧化性或还原性物质不能用直接滴定法或返滴定法测定时,可采用此法。
(3)标准溶液的配制与标定
①高锰酸钾溶液的配制市售KMnO4试剂常含有杂质,而且在光、热等条件下不稳定,会分解变质。因此高锰酸钾标准溶液不能直接配制使用,通常先配成浓溶液放置储存,需要时再取适量稀释成近似浓度的溶液,然后标定使用。
②高锰酸钾溶液的标定常用于标定KMnO4的基准物是Na2C2O4。Na2C2O4在105℃~110℃烘干2h,放入干燥器中冷却后,即可使用。已标定过的KMnO4溶液在使用一段时间后必须重新标定。标定反应为:2MnO4-+5C2O42-+16H+==2Mn2++10CO2↑+8H2O
(4)标定时注意事项:
①滴定速度:开始时因反应速度慢,滴定速度要慢;开始后反应本身所产生的Mn2+起催化作用,加快反应进行,滴定速度可加快。
②温度:近终点时加热至65℃,促使反应完全
③酸度:保持一定的酸度(3mol/LH2SO4)。
④滴定终点:滴入微过量高锰酸钾,利用自身的粉红色指示终点(30秒不褪色)。
6.碘量法
(1)基本原理碘量法是利用碘的氧化性、碘离子的还原性进行物质含量测定的方法。I2是较弱的氧化剂;I-是中等强度的还原剂。碘量法可用直接测定和间接测定两种方式进行。
(2)①直接碘量法(或碘滴定法)直接碘量法是直接用I2标准溶液滴定还原性物质,又叫做碘滴定法。直接碘量法只能在酸性、中性或弱碱性溶液中进行。直接碘量法可用淀粉指示剂指示终点。直接碘量法还可利用碘自身的颜色指示终点,化学计量点后,溶液中稍过量的碘显黄色而指示终点。
②间接碘量法(或滴定碘法)对氧化性物质,可在一定条件下,用I-还原,产生I2,然后用Na2S2O3标准溶液滴定释放出的I2。这种方法就叫做间接碘量法或滴定碘法。间接碘量法也是使用淀粉溶液作指示剂,溶液由蓝色变无色为终点。
③间接碘量法的反应条件和滴定条件
A. 酸度的影响:I2与Na2S2O3应在中性、弱酸性溶液中进行反应。
B. 防止I2挥发的方法:在滴定前,加入过量KI(比理论值大2~3倍),减少I2挥发。
C. 防止I-被氧化
(3)标准溶液的配制和标定
①碘标准溶液(0.05mol/L)的配制和标定
A. 配制由于碘具有挥发性和腐蚀性,通常情况下,碘标准溶液是采用间接法配制。配制0.05mol/L时,可取碘13g,加碘化钾36g与水50ml溶解后,加稀盐酸3滴与水适量稀释至1000ml,摇匀,贮存于棕色试剂瓶中备用。
B. 标定:用三氧化二砷(As2O3)为基准物质,甲基橙为指示剂,用待标定的碘标准溶液滴定至终点。
②硫代硫酸钠标准溶液(0.1mol/L)的配制和标定
A. 配制:Na2S2O3溶液采取间接法配制。操作步骤:称取硫代硫酸钠26g与无水碳酸钠0.2g,加新煮沸过的冷水适量稀释至1000ml,摇匀,放置8~10天,滤过,备用。
在Na2S2O3溶液的配制过程中应采取下列措施:
第一、为了除去水中的微生物,用新煮沸冷却后的蒸馏水配制。
第二、配制时加入少量的Na2CO3,使溶液呈弱碱性,可减少溶解在水中的CO2、O2和杀死微生物。
第三、将配制溶液置于棕色瓶中,放置8~10天,待其浓度稳定后再标定,但若发现溶液浑浊,需重新配制。
B. 标定:以K2Cr2O7为基准物,加入碘化钾置换出定量的碘,再用硫代硫酸钠标准溶液滴定碘
标定方法为:精密称取在120℃干燥至恒重的基准物质重铬酸钾0.15g,置碘量瓶中,加水50ml溶解,加碘化钾2.0g,轻轻振摇,加稀硫酸40ml,摇匀,密塞,水封后在暗处放置10分钟,取出加水50ml稀释,用待标定Na2S2O3溶液滴定至近终点时,加淀粉指示剂3ml,继续滴定至溶液由蓝色变亮绿色为终点。
滴定反应为:

氧化还原反应的计算:
(1)比较典型的计算有:求氧化剂、还原剂物质的量之比或质量比,计算参加反应的氧化剂货还原剂的量,确定反应前后某一元素的价态变化等。
(2)计算的依据是:氧化剂得电子数等于还原剂失电子数,列出守恒关系式求解。
(1)比较典型的计算有:求氧化剂、还原剂物质的量之比或质量比,计算参加反应的氧化剂货还原剂的量,确定反应前后某一元素的价态变化等。
(2)计算的依据是:氧化剂得电子数等于还原剂失电子数,列出守恒关系式求解。
氧化还原反应的基本规律:
1.守恒规律
氧化还原反应中有物质失电子必有物质得电子,且失电子总数等于得电子总数。或者说氧化还原反应中,有元素化合价升高必有元素化合价降低,且化合价升高总数必等于降低总数。有关得失电子守恒(化合价守恒)的规律有如下应用:
(1)求某一反应中被氧化与被还原的元素原子个数之比,或求氧化剂与还原剂的物质的量之比及氧化产物与还原产物的物质的量之比。
(2)配平氧化还原反应方程式。
(3)进行有关氧化还原反应的计算:
2.强弱规律
较强氧化性的氧化剂跟较强还原性的还原剂反应,生成弱还原性的还原产物和弱氧化性的氧化产物。应用:在适宜条件下,用氧化性较强的物质制备氧化性较弱的物质,或用还原性较强的物质制备还原性较弱的物质,也可用于比较物质间氧化性或还原性的强弱。
3.价态规律
元素处于最高价,只有氧化性;元素处于最低价,只有还原性;元素处于中间价态,既有氧化性又有还原性,但主要表现一种性质。物质若含有多种元素,其性质是这些元素性质的综合体现。
4.转化规律
氧化还原反应中,以元素相邻价态之间的转化最容易;不同价态的同种元素之间发生反应,元素的化合价只靠近,不交叉;相邻价态的同种元素之间不发生氧化还原反应。如

5.难易规律
越易失去电子的物质,失去后就越难得到电子;越易得到电子的物质,得到后就越难失去电子。一种氧化剂同时和几种还原剂相遇时,还原性最强的优先发生反应;同理,一种还原剂同时与多种氧化剂相遇时,氧化性最强的优先发生反应,如向FeBr2溶液中通入Cl2时,发生离子反应的先后顺序为:
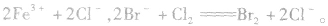 。
。
发现相似题
与“测血钙的含量时,可将2.0 mL血液用蒸馏水稀释后,向其中加入...”考查相似的试题有:
- 据报道,科学家发现了如下反应:O2+PtF6→O2(PtF6).已知O2(PtF6) 为离子化合物,其中Pt为+5价.对于此反应,下列说法正确...
- 阅读以下材料回答问题:中石油吉林石化公司双苯厂曾发生爆炸事故,约有100吨左右的苯、苯胺和硝基苯等污染物进入松花江水体。...
- 将19.2g的铜屑投入到400mL浓度均为0.5mol.L-1HNO3和H2SO4的混合溶液中,当转移0.45mol电子时溶液增加的质量为( )A.4.5gB...
- Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O,当NO2和NO的物质的量之比为1:1时,实际参加反应的Cu2S与HNO3...
- LiAlH4()、LiH既是金属储氢材料又是有机合成中的常用试剂,遇水均能剧烈分解释放出H2,LiAlH4在125 ℃分解为LiH、H2和Al。下列...
- NA表示阿伏加德罗常数的值,下列说法正确的是( )A.0.012千克石墨晶体中含共用电子对数目为2NAB.电解精炼铜时,若阴极得到...
- 亚硝酸钠是一种工业用盐,广泛用于物质合成、金属表面处理等,它的一些性质或用途如图,下列 说法不正确的是 [ ]A.NaNO2的稳...
- E为无色无味的液体,F为淡黄色粉末,G (反应条件均已略),请回答下列问题:(1)请写出F的电子式:_______;在反应②中,当生...
- 对于2NaBr+Cl2═2NaCl+Br2反应,下列说法不正确的是( )A.该反应既是置换反应,又是氧化还原反应B.Cl2是氧化剂,发生还原反...
- 氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为aHClO3→ bO2↑+ cCl2↑+ dHClO4+ eH2O,(1)该反应的氧化产物是_____...