本试题 “下列实验的失败原因可能是因为缺少必要的实验步骤造成的是:( )①将乙醇和乙酸混合,再加入稀硫酸共热制乙酸乙酯②实验室用无水乙醇和浓硫酸共热到140℃制乙烯...” 主要考查您对乙醛
乙烯的制取
乙酸乙酯的制备
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 乙醛
- 乙烯的制取
- 乙酸乙酯的制备
乙醛分子结构: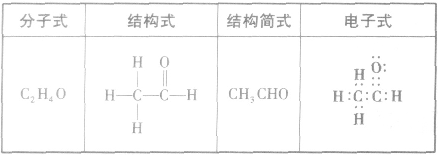
乙醛的性质:
1、物理性质
乙醛是无色、有刺激性气味的液体,密度小于水,沸点为20.8℃。乙醛易挥发,易燃烧,能与水、乙醇、氯仿等互溶。冈为乙醛易挥发,易燃烧,故在使用纯净的乙醛或高浓度的乙醛溶液时要注意防火。
3.化学性质
乙醛分子中的醛基(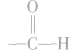 )对乙醛的主要化学性质起决定作用。
)对乙醛的主要化学性质起决定作用。
(1)加成反应
乙醛分子中醛基上的碳氧双键与碳碳双键相似,能够发生加成反应。如使乙醛蒸气和氢气的混合气体通过热的催化剂,乙醛与氢气即发生加成反应:
说明:a.乙醛的催化加氢反应也是还原反应。
b.常见的能发生加成反应的官能团(或基团)有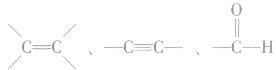 等,但它们发生加成反应的条件不同。
等,但它们发生加成反应的条件不同。
c.由乙醇的催化氧化反应和乙醛的催化加氢反应可知,乙醇和乙醛可在一定条件下相互转化: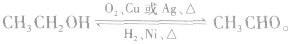
(2)氧化反应
①与银氨溶液的反应——银镜反应
Ag(NH3)2OH(氢氧化二氨合银)是一种弱氧化剂,能把乙醛氧化成乙酸,乙酸又与氨反应生成乙酸铵,而Ag+被还原成金属银附着在试管壁上,形成银镜,所以,这个反应叫做银镜反应。银镜反应常用来检验醛基的存在。工业上可利用这一反应原理,把银均匀地镀在玻璃上制成镜子或保温瓶胆(生产上常用含有醛基的葡萄糖作为还原剂)。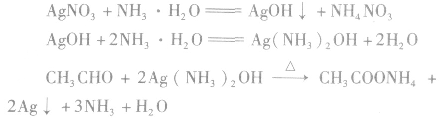
注意a.实验所用试管(玻璃)要洁净。
b.银氨溶液要新配制的,配制银氨溶液是向 AgNO3稀溶液中逐滴加入稀氨水,直到最初生成的沉淀恰好溶解为止。要防止氨水过量,并且必须随配随用,不可久置,否则会生成容易爆炸的物质。
c.实验条件是水浴加热,不能直接加热煮沸。
②与新制氢氧化铜的反应在试管里加入10%的NaOH溶液2mL,滴入2%的CuSO4溶液4~6滴,得到新制的氢氧化铜,振荡后加入乙醛溶液0.5mL,加热煮沸。观察并记录实验现象。
实验现象:生成红色沉淀。
实验结论:在加热的条件下,乙醛能与新制的氢氧化铜发生化学反应。
乙醛与新制的氢氧化铜反应的实验中,涉及的主要化学反应是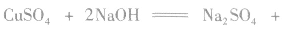
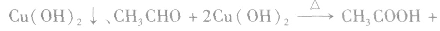
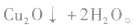 反应中新制的氢氧化铜将乙醛氧化为乙酸,它本身被还原为氧化亚铜(Cu2O)。Cu2O是红色固体,不溶于水,也不与乙酸反应。
反应中新制的氢氧化铜将乙醛氧化为乙酸,它本身被还原为氧化亚铜(Cu2O)。Cu2O是红色固体,不溶于水,也不与乙酸反应。
乙醛与新制的氢氧化铜的反应原理,可用于在实验室里检验醛基的存在,在医疗上检验尿糖。
说明:a.制备新制的Cu(OH)2是在NaOH溶液中滴加少量CuSO4溶液,应保持碱过量;
b.反应条件必须是加热到沸腾。
③与氧气的反应乙醛如在一定温度和催化剂存在的条件下,也能被空气中的氧气氧化成乙酸:
在点燃的条件下,乙醛能在空气或氧气中燃烧。 乙醛完全燃烧的化学方程式为: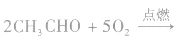
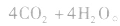
注意a.在工业上,可以利用乙醛的催化氧化反应制取乙酸。
b.银氨溶液、新制氢氧化铜的氧化性很弱,乙醛能被这样的弱氧化剂氧化,原因是乙醛的还原性很强。由此推理,乙醛也易被酸性高锰酸钾溶液、溴水等氧化,高锰酸钾、溴被还原而使溶液褪色。
乙烯的制取:
(1)实验室里是把酒精和浓硫酸按1:3混合迅速加热到170℃,使酒精分解制得。浓硫酸在反应过程里起催化剂和脱水剂的作用。
制取乙烯的反应属于液--液加热型
C2H6O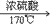 CH2=CH2↑+H2O
CH2=CH2↑+H2O
(2)装置图: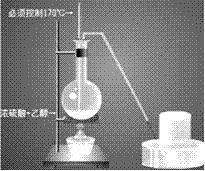
(3) 注意事项:
①酒精和浓硫酸按体积1比3混和,使乙醇利用率提高,必须使用无水酒精,而且必须控制170摄氏度才能制得乙烯。装置连接时由下至上,由左至右。温度计插入液面下。
②烧瓶内加沸石以避免暴沸。
③温度计水银头插入液面下,但不要接触烧瓶底部,以测定液体温度。
④要使液面温度迅速升到170摄氏度,以避免副反应发生。
(4)收集方法:乙烯的密度与空气相当,所以不能用排空气取气法,只能用排水法收集。
检验:点燃时火焰明亮,冒黑烟,产物为水和CO2;通入酸性高锰酸钾溶液中,紫色高锰酸钾褪色。
(5)实验现象:生成无色气体,烧瓶内液体颜色逐渐加深。
(6)两点说明
①实验室中用无水乙醇和浓硫酸制取乙烯气体,加热不久圆底烧瓶内的液体容易变黑,原因是:浓硫酸将无水乙醇氧化生成碳单质等多种物质,碳单质使烧瓶内的液体带上了黑色。制得的C2H4中往往混有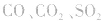 等气体。
等气体。
②实验时要求使反应温度迅速卜升到170℃并稳定在170℃左右,因该温度下主要产物是乙烯和水,而在140℃时主要产物是乙醚和水,当温度高于170℃ 时,乙醇和浓硫酸发生的氧化反应更加突出,反应产物有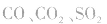 等多种物质。相关反应方程式为:
等多种物质。相关反应方程式为: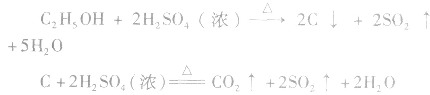
(1)实验目的:
掌握用醇和羧酸制备酯的方法。
(2)试剂:
乙醇、冰醋酸、浓硫酸、饱和碳酸钠水溶液、饱和食盐水、饱和氯化钙、无水硫酸镁(或无水硫酸钠) 2~3g (用于干燥乙酸乙酯)
(3)反应原理:
主反应:
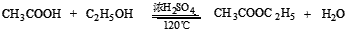
副反应:
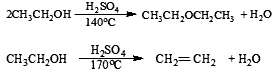
(4)反应装置图:
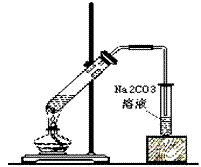
(5)操作步骤
①在一个大试管里注入乙醇2mL,再慢慢加入0.5mL浓硫酸、2mL乙酸,连接好制备乙酸乙酯的装置。
②用小火加热试管里的混合物。把产生的蒸气经导管通到3mL饱和碳酸钠溶液的上方约2mm~3mm处,注意观察盛碳酸钠溶液的试管的变化,待有透明的油状液体浮在液面上,取下盛有碳酸钠溶液的试管,并停止加热。振荡盛有碳酸钠溶液的试管,静置,待溶液分层后,观察上层液体,并闻它的气味。
③加热混合物一段时间后,可看到有气体放出,在盛碳酸钠溶液的试管里有油状物。
(6)注意事项:
1、酯化反应所用仪器必须无水,包括量取乙醇和冰醋酸的量筒也要干燥。
2、加热之前一定将反应混合物混合均匀,否则容易炭化。
3、分液漏斗的正确使用和维护。。
4、用10%碳酸钠水溶液洗涤有机相时有二氧化碳产生,注意及时给分液漏斗放气,以免气体冲开分液漏斗的塞子而损失产品。
5、正确进行蒸馏操作,温度计的位置影响流出温度,温度计水银球的上沿与蒸馏头下沿一平。
6、有机相干燥要彻底,不要把干燥剂转移到蒸馏烧瓶中。
7、反应和蒸馏时不要忘记加沸石。
8、用CaCl2溶液洗之前,一定要先用饱和NaCl溶液洗,否则会产生沉淀,给分液带来困难。
与“下列实验的失败原因可能是因为缺少必要的实验步骤造成的是:...”考查相似的试题有:
- 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成请回答下列问题:(1)A与银氨溶液反应有银镜生成,则A的结构简式是...
- 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:(1)A与银氨溶液反应有银镜生成,则A的结构简式是_____________...
- 小王同学准备用CuSO4·5H2O配制480 mL 1 mol/L的溶液。(1)小王同学选用的容量瓶容积的规格是 mL;(2)玻璃棒在该实验中有重...
- 纳米氧化镁具有特殊的热、光、电、力学和化学等性能,有广泛的应用前景。下图是利用海水制盐的副产品制备纳米氧化镁的流程图...
- (1)写出实验室制乙烯的化学方程式(2)该实验需加入碎瓷片目的是(3)下列实验操作正确的是A、配制乙醇与浓硫酸的混合液时...
- 实验室制取下列气体时,其发生装置相同的一组是A.C2H4和O2B.CO2和 Cl2C.NH3和O2D.Cl2和H2
- 海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO的实验方案:注:溶液中某种离子的浓度小于1.0×10-5mo1/L,可认为...
- 下图是制取气体的一种装置,能用此装置制取气体并能“随开随用,随关随停”的是( )A.碱石灰与浓氨水制NH3B.铝片与烧碱溶液...
- 实验室用下图装置制取少量溴苯,试填写下列空白。(1)在烧瓶a中装的试剂是 、 、 。(2)请你推测长直导管b的作用:一是 ,...
- (1)酯化反应:_____跟________ 作用而生成____ 和____________ 的反应。(2)断键规律:酸去_________ 基醇去___________ ...