本试题 “铁是人们广泛使用的金属,下列关于铁的说法正确的是( )A.纯净的生铁属于金属单质B.铁是地壳中含量最多的金属元素C.人类的历史上铁器的使用早于铜器D.铁...” 主要考查您对化学发展史
地壳中各种元素的含量
合金
金属的化学性质
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 化学发展史
- 地壳中各种元素的含量
- 合金
- 金属的化学性质
化学的发展:
1.我国商代有了青铜器,春秋晚期能炼铁,战国时期能炼钢,唐代有了火药。
2.1774年法国化学家拉瓦锡提出了空气主要是由氧气和氮气组成的。
3.瑞典化学家舍勒和英国化学家普利斯特里先后用不同的方法制得了氧气。
4.1776年俄国化学家罗蒙诺索夫建立了质量守恒定律。
5.十九世纪初英国科学家道尔顿提出了近代原子学说。
6.1811年意大利科学家阿佛加德罗提出了分子的概念。
7.1869年俄国化学家门捷列夫发现了元素周期律。
化学发展六个时期:
(一)史前期:从远古到公元前1500年,化学作为一种技术,实际上已经开始出现了。尽管在这个期间,并没有文字记载,但是在中国、埃及、印度、巴比伦和后来的希腊、罗马,都可以找到人类利用化学的遗迹。猿人就知道用火,知道用火煮东西和烧制陶器。这可以说是最早期化学的开始。
(二)炼丹时期:大体说来是从公元前1500年到公元1650年。这个时期中国在化学方面的著作最多,例如《参同契》、《道藏》以及重要的本草书,都对我国古代化学成就作了详细的记载。至於在欧洲,这方面的书籍也很不少,例如阿拉伯、埃及和希腊,在1572年就有一部书,书名是《炼金的化学方法》。在欧洲,已经开始有“化学”这个名词了,并在1572年出版了《化学原理》(ArtisChemiaePrincipes)一书。许多希腊、阿拉伯、罗马的有名学者,例如帕拉图、阿里士多德、阿维森纳、给伯尔,都写了有关化学方面的书,在这方面最有力的证据乃是这些学者开始认识到实验是科学工作的重要工具。
(三)医药化学时期:在1500—1700年这两百年间,欧洲发生了很大的变化,科学史上称之为复兴时期。在这个时期欧洲出版了很多最早的化学著作,例如德国化学家格劳贝尔于1684年写的《新哲学的炉》;德国化学家孔柯尔写的《化学实验》;德国冶金学家阿格里柯拉写过一本名为“DeReMetallica”的书,中国明崇祯十六年李天经和汤若望将此书翻译出版,中文书名《坤舆格致》,可以说是中国最早翻译的化学书籍。
(四)燃素时期:这个时期从1650年到1775年,在这个时期出现了很多化学家,例如德国化学家施塔尔,他写过《化学基础》一书,是1723年出版的。还有德国化学家贝歇尔,他写过《冶金术》一书和很多其他著作。尽管他们的理论是不正确的,可是他们做了很多实验,积累了许多感性知识。一直到1661年,英国化学家波义耳写了《怀疑派化学家》一书,才开始对于元素理论有了基本的认识。
(五)定量时期:这个时期从1775年至1900年,这一时期化学研究的目的是开始利用化学知识解决工农业上的许多问题,并利用定量的化学实验建立了不少化学基本定律。这个时期又称为近代化学发展时期,很多科学家写了许多著名的书籍和论文,特别是英国化学家道尔顿在1808年所写的《化学哲学新体系》一书,提出了原子学说;法国化学家拉瓦锡於1777年发表《燃烧概论》论文,建立了燃烧作用的氧学说,并确立了物质不灭定律,使化学开始进入近代化学时期。接下来,瑞典化学家贝采里乌斯开始使用化学符号;俄国化学家门捷列夫发表周期律;德国化学家李比希和维勒在发展有机化学上作出了重要贡献,都为现代化学的发展奠定了基础。
(六)科学相互渗透时期:这个时期基本上从二十世纪初开始。一方面,物理学提出的量子论使化学和物理学有了共同的语言。另一方面化学又向生物学和地质学等学科渗透,使过去很难解决的蛋白质、酶等的结构问题,正在逐步得到解决。过去认为原子是看不见的,现在不但可以用超显微镜看到原子,而且原子本身的能量也已经开始被人们利用了。
地壳是由沙、黏土、岩石等组成的,其中含量最多的是氧元素,含量排在第二位至第五位的元素依次是硅、铝、铁、钙等。地壳中含量最高的非金属元素是氧元素;地壳中含量最高的金属元素是铝元素。(关键记清地壳中含量最高的前四位元素)
海水中元素分布:
海水中的元素分布海洋约占地球表面的70%左右,海水中的元素含量分布如下表所示。其中含量最多的是氧元素。其次是氢元素,这两种元素约占总量的96.5%。
| 元素 | O | H | Cl | Na、Mg |
| 质量分数/% | 85.5 | 10.7 | 2.0 | 1.5 |
人体中元素分布:
水占人体体重的70%左右。组成人体的元素中含最最多的是氧元索,其次是碳、氢、氮元素。碳,氢、氮三种元素在地壳中的含量较少,但却是生命的必需元素。
| 元素 | O | C | H | N | Ca | P | S、K |
| 质量分数/% | 65 | 18 | 10 | 3 | 1.5 | 1.0 | 1.5 |
合金是在金属中加热熔合某些金属或非金属形成的具有金属特性的物质。
①合金可以是金属与金属或金属与非金属的混合物,不一定全部由金属组成。
②合金具有金属特性,如导电性、导热性、延展性等。
③合金是几种成分熔合在一起形成的,发生的是物理变化,不是化学变化;合金不是几种成分简单地混合而成的。
④合金中各成分仍保持自己的性质。
合金与组成它们的金属的性质比较:
金属熔合了其他金属或非金属后,不仅组成上发生了变化,其内部结构也发生了改变,从而引起性质的变化。因而合金比纯金属具有更广泛的用途。 纯金属与合金性质的比较:
①合金一般比其组分金属的颜色更鲜艳。
②合金的硬度一般应工组成它的金属。
③合金的熔点一般低于成它的金属。
④合金的抗腐蚀能力一般强工组成它的金属。
⑤合金的导电性、导热隆能一般差于组成它的金属。
生铁和钢的比较:
| 含碳量 | 2%—4% | 0.03%—2% |
| 其他元素 | Si、Mn、S、P(少量) | Si、Mn等 |
| 机械性能 | 硬而脆,无韧性 | 坚硬,韧性大,塑性好,有弹性 |
| 机械加工性质 | 可铸不可锻 | 可铸,可锻,可压延 |
| 分类 | 白口铁,灰口铁,球墨铸铁 | 碳素钢,合金钢 |
知识点拨:
①生铁和熟铁:生铁是指含碳债在 2%一4.3%之间的铁合金,熟铁是用生铁精炼而成的较纯的铁,含碳量低于0.02%。
②生铁与铸铁:铸铁是生铁中的一种,是指可用来铸造的生铁,通常指球墨铸铁。
③碳素钢的性能与含碳址有关,含碳量越高,硬度越大,但韧性越差;含碳量越低,韧性越好,但硬度越小。
④纯铁与日常生活中铁的颜色差异日常生活,我们接触的铁一般不是纯铁,而是一些铁的氧化物或含铁的混合物,故我们常见的铁的颜色是黑色的,但它并不是纯铁的颜色,纯铁的颜色是银白色的。
应用广泛的合金:
(1)铁合金:铁合金包括生铁和钢,生铁和钢的主要成分是铁,钢与生铁的各种性能不同,主要是由于二者的含碳量不同。
生铁与钢的种类
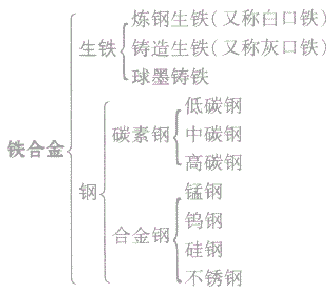
(2)生铁与钢:
生铁的含碳量为2%—4.3%
钢的含碳量为0.03%—2%
(3)钛和钛合金:钛和钛合金被认为是21世纪的重要金属材料。
①性质:优异的耐腐蚀性,对海水、空气和若干腐蚀介质都稳定,可塑性好,强度大,密度小,又称亲生物金属;
②用途:喷气发动机、飞机.机身、人造卫星外壳、火箭壳体、医学补形、人造骨、海水淡化设备、海轮和舰艇的外壳等。
常见金属能与氧气反应,也能与盐酸,硫酸及盐溶液反应。
常见金属的化学性质:
1.金属和氧气的反应
| 金属 | 在空气中 | 在氧气中 | 方程式 |
| 镁 | 常温下表面逐渐变暗。点燃 剧烈燃烧,发出耀眼的白光, 生成白色固体 |
点燃,剧烈燃烧,发出耀 眼的白光,生成白色固体 |
2Mg+O2 2MgO 2MgO |
| 铝 | 常温下,铝表而变暗,生成一 层致密氧化膜,保护铝不再被腐蚀 |
点燃。剧烈燃烧,火星四射, 放出大量的热,生成白色固体 |
4Al+3O2 2Al2O3 2Al2O3 |
| 铁 | 持续加热发红,离火变冷 | 火星四射,放出大量的热, 生成黑色固体 |
3Fe+2O2 Fe3O4 Fe3O4 |
| 铜 | 加热,生成黑色物质,在潮湿的 空气中,生成铜绿而被腐蚀 |
加热,生成黑色固体 | 2Cu+O2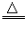 2CuO 2CuO |
| 金 | 即使在高温也不和氧气反应 | —— | |
| 结论 | 大多数金属都能喝氧气反应,但反应的难易程度和剧烈程度不同 | ||
2.金属与酸的反应
| 盐酸 | 稀硫酸 | 反应现象(两种酸中相同) | |
| 镁 | Mg+2HCl==MgCl2+H2↑ | Mg+H2SO4==MgSO4+H2↑ | 反应比较剧烈,产生大量 气泡,溶液仍为无色,生成 的气体能够燃烧,并且产 生淡蓝色火焰 |
| 铝 | 2Al+6HCl==2AlCl3+3H2↑ | 2Al+3H2SO4==Al2(SO4)+3H2↑ | |
| 锌 | Zn+2HCl==H2↑+ZnCl2 | Zn+H2SO4==ZnSO4+H2↑ | 反应缓慢,有气泡产生,溶 液由无色逐渐变为浅绿色, 生成的气体能够燃烧,并且 产生淡蓝色火焰 |
| 铁 | Fe+2HCl==FeCl2+H2↑ | Fe+H2SO4==FeSO4+H2↑ | |
| 铜 | 不反应 | 不反应 | 无 |
3.金属与盐的反应
将锌片、铁丝、铜丝三种金属分别放入硫酸铜溶液、硝酸银溶液、氯化钠溶液中,观察现象
| CuSO4溶液 | AgNO3溶液 | NaCl溶液 | |
| 锌 | 锌表面有一层红色金属析出,溶液由蓝色变为无色 Zn+CuSO4==ZnSO4+Cu |
锌表面有一层银白色金属析出 Zn+2AgNO3==Zn(NO3)2+2Ag |
无变化,不反应 |
| 铁 | 铁表面有一层红色金属析出,溶液由蓝色变为浅绿色 Fe+CuSO4==FeSO4+Cu |
铁表面有一层银白色金属析出,溶液由无色变为浅绿色 Fe+2AgNO3==Fe(NO3)2+2Ag |
无变化,不反应 |
| 铜 | 无变化,不反应 | 铜表面有一层银白色金属析出,溶液由无色变为蓝色 Cu+2AgNO3==Cu(NO3)2+2Ag |
无变化,不反应 |
易错点:
一、(1)一般在金属活动性顺序表中排在氢前面的金属(也叫活泼金属)能置换出酸中的氢;排在氢后面的金属则不能,如铜、银与盐酸、稀硫酸都不反应。
(2)浓硫酸和硝酸与金属反应不生成氢气,因为它们有很强的氧化性,与金属反应不生成氢气。
(3)在金属活动性顺序表中排在最前面的金属如K、 Na活泼性太强,放入酸溶液中首先跟酸发生置换反应,过M的金属会继续跟水发生剧烈的反应。
(4)铁与非氧化性酸反应时,始终生成亚铁盐 (Fe2+)。
(5)金属与酸反应后溶液的质量增大。
二、
(1)在金属活动性顺序表中,位于前面的金属可以把位于其后面的金属从它们的盐溶液中置换出来(K,Ca,Na除外)。相隔越远,反应越容易发生。
(2)金属与盐溶液的反应,盐必须能溶于水,不溶性的盐与金属不反应,如AgCl难溶于水,Fe和AgCl不反应。
(3)不能用活泼的金属K,Ca,Na,与盐溶液反应,因为K,Ca,Na。会先与H2O发生置换反应生成碱和氢气。
金属与酸的反应不一定属于置换反应:
置换反应是指一种单质和一种化合物反应生成另一种单质和另一种化合物的反应。一般情况下,较活泼的金属跟酸发生的化学反应属于置换反应。但由于浓硫酸(或硝酸)具有强氧化性,金属与浓硫酸(或硝酸)反应时,生成物相对比较复杂。这类反应不属于置换反应。
铝和锌的抗腐蚀性:
1.铝制品具有很好的抗腐蚀性,是因为铝与空气中的氧气反应表面生成一种致密的氧化铝薄膜,对铝起防护作用。
2.锌与铝的抗腐蚀性相似,也是在金属表面会生成一层致密的氧化锌保护膜。
与“铁是人们广泛使用的金属,下列关于铁的说法正确的是( )A....”考查相似的试题有:
- 下面是某同学整理的部分化学知识,其中有错误的是[ ]A.地壳中几种元素含量的比较:O>Si>AlB.构成物质的几种粒子:分子、原...
- 制取合金的方法是将两种或两种以上的金属(或金属与非金属)加热到某一温度使其全部熔化,再冷却成为合金。试根据下表中的数...
- 金属材料与人类的生产、生活息息相关。(1)人们习惯上称为“五金”的金、银、铜、铁、锡中,把金属______(填元素符号)的位置...
- 下列物质的应用不正确的是( )A.用水浇灌庄稼B.不锈钢用于制餐具C.熟石灰改良酸性土壤D.氧气用于光合作用
- 某兴趣小组从铜器上取下绿色粉未,设计如下实验步骤进行探究铜绿的组成.(1)写出:B物质的化学式______;铜绿的组成元素___...
- 把锌片放入溶液中充分反应,反应后溶液的质量比反应前减少的是( )A.稀盐酸B.硫酸镁溶液C.硫酸亚铁溶液D.硝酸银溶液
- 下列金属在常温下能与干燥的空气发生反应是( )A.铁B.铜C.铝D.银
- 同学们探究金属A,B,C,D的活动性强弱,设计了如下的实验方案:将A放入到B的盐溶液中,无明显现象;将形状和大小相同的A,B...
- 常见金属活动性顺序如图4:下列各组物质间能发生反应的是A.铜和硝酸钠溶液B.铁和稀盐酸C.锌和氯化钾溶液D.银和稀硫酸
- 做“镁带在空气中燃烧”实验时,小科同学发现生成物中有少量黑色固体.黑色固体是镁和什么物质反应所产生的?他提出下列猜想:...