本试题 “取44.2 g碳酸钠和碳酸氢钠的混合粉末样品,将其分成两等份,取其中一份加热到质量不再改变,冷却后称其质量为15.9 g;另一份溶于水,配成500 mL溶液。 试计算...” 主要考查您对物质的量浓度
碳酸氢钠
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 物质的量浓度
- 碳酸氢钠
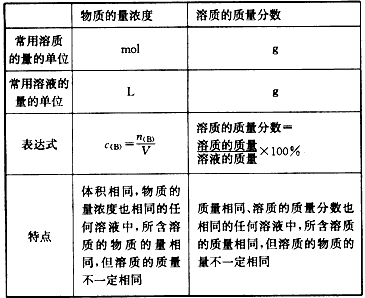
物质的量浓度:
定义:单位体积的溶液里所含溶质B的物质的量,也称为B的物质的量浓度
符号:cB
单位:mol/L(mol·L -1)
计算公式:物质的量浓度(cB)=物质的量(n)/溶液的体积(V)
物质的量浓度与溶液质量分数、密度的关系:c=1000ρω/M
稀释定理:
- 稀释前后溶液中溶质的物质的量不变
c(浓溶液)V(浓溶液)=c(稀溶液)V(稀溶液) - 稀释前后溶液中溶质的质量不变
ρ(浓溶液)V(浓溶液)w%(浓溶液)=ρ(稀溶液)V(稀溶液)w%(稀溶液)
物质的量浓度与质量分数(质量百分比浓度)的比较:
浓度计算的注意事项:
物质的量浓度(cB)=物质的量(n)/溶液的体积(V)
(1)V指溶液体积而不是溶剂的体积;
(2)取出任意体积的1mol/L溶液,其浓度都是1mol/L。但所含溶质的量则因体积不同而不同;
(3)“溶质”是溶液中的溶质,可以是化合物,也可以是离子或气体特定组合,特别的,像NH3、Cl2等物质溶于水后成分复杂,但求算浓度时,仍以溶解前的NH3、Cl2为溶质,如氨水在计算中使用摩尔质量时,用17g/mol。
溶液中溶质的质量分数与溶质的物质的量浓度的换算:
- 溶液中溶质的质量可以用溶质的质量分数表示: m(溶质)=ρ(g·cm-3)·V(L)·w% (1cm3=1mL)
- 溶液中溶质的质量可以用物质的量浓度来表示: m(溶质)=c(mol/L)·V(L)·M(g·mol-1)
- 由于同一溶液中溶质的质量相等,溶液的体积也相等,但注意:1L=1000mL,所以,上述两式可以联系起来:
ρ(g·cm-3)·1000V(mL)·w%=c(mol/L)·V(L)·M(g·mol-1) 化简得:1000ρw%=cM
碳酸氢钠(NaHCO3):
(1)俗名:小苏打;细小白色晶体,溶解度小于Na2CO3,受热易分解,可用于治疗胃酸过多、发酵剂
(2)与H+反应:HCO3-+H+==CO2↑+H2O
(3)与NaOH反应:HCO3-+OH-==CO32-+H2O
(4)与石灰水反应:生成CaCO3沉淀
(5)与BaCl2和CO2不反应
碳酸氢钠的物理性质:
碳酸氢钠为白色晶体,或不透明单斜晶系细微结晶。比重2.15g。无臭、味咸,可溶于水,不溶于乙醇。其水溶液因水解而呈微碱性,常温中性质稳定,受热易分解,在50℃以上迅速分解,在270℃时完全失去二氧化碳,在干燥空气中无变化,在潮湿空气中缓慢分解。溶解度:7.8g,18℃;16.0g,60℃。
碳酸氢钠的用途:
碳酸氢钠可直接作为制药工业的原料,用于治疗胃酸过多。
Na2CO3、NaHCO3的性质比较:
| 表示 | 名称 | 碳酸钠 | 碳酸氢钠 |
| 化学式 | Na2CO3 | NaHCO3 | |
| 俗称 | 苏打 | 小苏打 | |
| 物理性质 | 色态 | 白色粉末 | 白色晶体 |
| 溶解性 | 易溶于水 | 能溶于水 | |
| 化学性质 | 与盐酸反应 | Na2CO3+2HCl=2NaCl+H2O+CO2↑ | NaHCO3+HCl=NaCl+H2O+CO2↑ |
| 热稳定性 | 很稳定 | 受热分解:2NaHCO3=(加热)=Na2CO3+H2O+CO2↑ | |
| 与NaOH反应 | 不反应 | NaHCO3+NaOH=Na2CO3+H2O | |
| 相互转化 | Na2CO3+H2O+CO2=2NaHCO3 | NaHCO3+NaOH=Na2CO3+H2O 2NaHCO3=(加热)=Na2CO3+H2O+CO2↑ |
Na2CO3、NaHCO3的鉴别:

Na2CO3、NaHCO3与足量盐酸反应的比较:
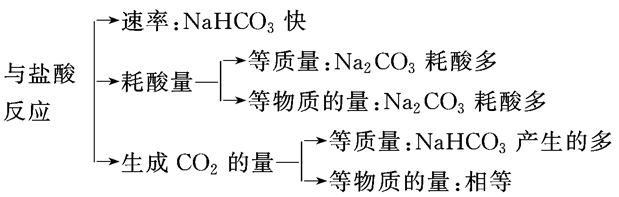
碳酸钠、碳酸氢钠与盐酸反应的基本图像的归纳总结:
(1)向Na2CO3中逐滴加入盐酸,消耗HCl的体积与产生CO2的体积的关系如图1所示;
(2)向NaHCO3中逐滴加入盐酸,消耗HCl的体积与产生CO2的体积的关系如图2所示;
(3)向NaOH、Na2CO3的混合物中逐滴加入盐酸,消耗HCl的体积与产生CO2的体积的关系如图3所示(设NaOH、Na2CO3的物质的量之比x∶y=1∶1,其他比例时的图像略);
(4)向Na2CO3、NaHCO3的混合物中逐滴加入盐酸,消耗HCl的体积与产生CO2的体积的关系如图4所示(设Na2CO3、NaHCO3的物质的量之比m∶n=1∶1,其他比例时的图像略)。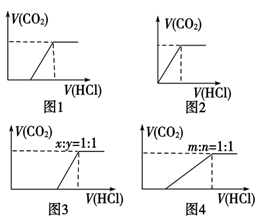
与“取44.2 g碳酸钠和碳酸氢钠的混合粉末样品,将其分成两等份,...”考查相似的试题有:
- 某盐酸的密度为1.05g/cm3,HCl的质量分数为10.0%,试计算:(1)该盐酸的物质的量浓度是多少?(2)200mL该盐酸跟过量的锌粒...
- 下列溶液中c(Cl-)与50mL 1mol/L AlCl3溶液中c(Cl-)相等的是( )A.150 mL 1 mol/L的NaCl溶液B.75 mL 2 mol/L的NH4Cl溶...
- 在 NaCl与MgCl2的混合液中,Na+与Mg2+的物质的量之比为1:2.如果混合液中共有0.5mol Cl-,溶液的体积为0.5L,则混合液中氯化...
- 把0.05mol醋酸分别加入到下列100mL溶液中,溶液的导电能力变化最明显的( )A.0.5mol/LNaOH溶液B.0.5mol/L盐酸C.0.5mol/LN...
- 现用98%的浓H2SO4(ρ=1.84g/cm3)配制成0.5mol/L的稀H2SO4500mL(1)所用浓硫酸的物质的量浓度为______mol/L.(2)所需浓H2S...
- V mL Al2(SO4)3溶液中含有Al3+m克,取V4mL溶液稀释到4V mL,则稀释后溶液SO42-的物质的量浓度是( )A.125m9V mol/LB.125...
- 将9.58gNa2CO3•10H2O与NaHCO3的混合物溶于水配成100mL溶液,测得c(Na+)=1mol/L.再取同质量的混合物,充分加热至质量不变时...
- 下列说法正确的是( )A.明矾水解形成的Al(OH)3 胶体能吸附水中悬浮物,可用于水的净化B.向SO2 水溶液中滴加盐酸酸化的Ba...
- 下图表示向某Na2CO3溶液中滴入稀盐酸产生CO2的过程:(1)写出a点以前发生反应的离子方程式____________________(2)写出a点到b...
- 用下列实验装置完成对应的实验,能达到目的是( ) A.吸收多余的NH3 B.分离沉淀和胶体 C.比较NaHCO3、Na2CO3的热稳定性 D...