本试题 “向溴化亚铁溶液中加入足量新制氯水,然后将溶液蒸干并充分灼烧,最后得到的固体是[ ]A.Fe2O3B.FeCl3C.FeOD.Fe(OH)3” 主要考查您对亚铁盐(二价铁离子)
氯水
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 亚铁盐(二价铁离子)
- 氯水
浅绿色溶液,既有氧化性性又具有还原性,主要表现还原性
(1)与氧化剂反应生成三价铁 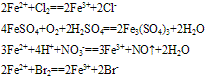
(2)与碱反应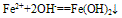
(3)Fe2+易被氧化,水溶液中易水解。亚铁盐溶液(FeCl2)在保存时加入少量铁屑以防止Fe2+被氧化,滴入少量相应的酸溶液(HCl),防止Fe2+水解。
氯水的成分:
新制氯水中存在的分子有盐酸(HCl)、次氯酸(HClO),水(H2O)、还有氯气
氯水的性质:
新制氯水呈黄绿色、有刺激性气味,属于混合物,其所含的多种微粒使氯水的化学性质表现出多重性。
①氯水的Cl2氧化性,只表现氯水的氧化性
A. 在某些含非金属阴离子的溶液中加氯水。
| 氯水滴加溶液 | 反应方程式 | 实验现象 |
| KI溶液 | 2KI+Cl2==2KCl+I2 | 溶液由无色变橙黄色 |
| NaBr溶液 | 2NaBr+Cl2==NaCl+Br2 | 溶液由无色变橙色 |
| K2S溶液 | K2S+Cl2==2KCl+S↓ | 溶液变浑浊 |
| Na2SO3溶液 | Na2SO3+Cl2+H2O==Na2SO4+2HCl | 氯水颜色褪去 |
C. 某些强还原性的气体通入氯水中,氯气将其氧化。
| 通入的气体 | 化学方程式 | 实验现象 |
| H2S | H2S+Cl2==2HCl+S↓ | 溶液出现浑浊 |
| HBr | 2HBr+Cl2==2HCl+Br2 | 溶液由浅黄绿色变橙色 |
| HI | 2HI+Cl2==2HCl+I2 | 溶液由浅黄色变橙黄色 |
| SO2 | SO2+Cl2+2H2O==H2SO4+2HCl | 溶液浅黄色褪去 |
A. 新制氯水滴入NaOH溶液等强碱溶液中,氯水褪色:
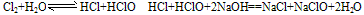
B. 新制氯水中滴加紫色石蕊试液时,溶液先变红色,后褪色,是盐酸的强酸性和次氯酸的强氧化性共同作用的结果。 ③氯水中次氯酸的强氧化性。
新制氯水起漂白作用时,是由于HClO的强氧化性将色素氧化使之褪色的结果,也是Cl2的漂白、杀菌、消毒作用必须有水存在的根本原因。
④氯水中盐酸的强酸性。
在AgNO3溶液中滴加适量的氯水,有白色沉淀生成。是氯水中的HCl与AgNO3作用的结果。
⑤氯水中盐酸的强酸性和氯气的强氧化性共同起作用。
向氯水中加镁粉、铝粉等活泼金属时,可观察到氯水颜色褪去且有气泡冒出,氯水中的Cl2和HCl与镁、铝共同作用的结果。
有关氯水问题的分析方法:
1.氯水性质的多样性
氯气溶于水形成的溶液叫氯水,新制的氯水呈浅黄绿色,有刺激性气味。氯水中存在三个平衡:
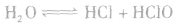 ,
,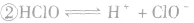 ,
,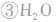
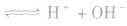 。所以,在氯水中存在三种分子:Cl2、 H2O、HClO;四种离子:H+、Cl-、ClO-及少量OH-。由于在光照条件下HClO可分解
。所以,在氯水中存在三种分子:Cl2、 H2O、HClO;四种离子:H+、Cl-、ClO-及少量OH-。由于在光照条件下HClO可分解
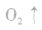 ,故久置的氯水为盐酸。
,故久置的氯水为盐酸。
(1)氯水的性质氯水在与不同物质发生反应时,表现出成分的复杂性和性质的多样性。
说明:
①氯水通常现用现制,可短时间密封保存于棕色试剂瓶中(见光或受热易分解的物质均保存在棕色试剂瓶中);
②Cl:使湿润的蓝色石蕊试纸先变红,后褪色。
(2)新制氯水、久置氯水、液氯的区别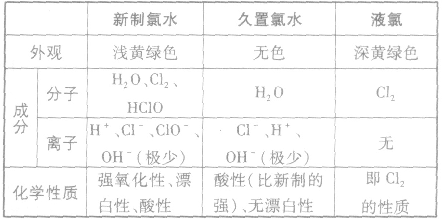
外界因素对平衡 的影响:
的影响:
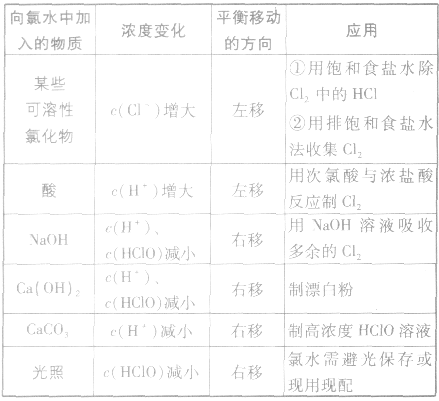
卤离子的检验方法:
1.银盐法:
特别提醒:加入稀HNO3的目的是防止CO32-、 PO43-等离子的干扰。有关反应为: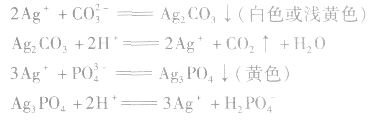
2.置换一萃取法
3.置换一淀粉法检验I-
发现相似题
与“向溴化亚铁溶液中加入足量新制氯水,然后将溶液蒸干并充分灼...”考查相似的试题有:
- 下列物质中,不能使酸性KMnO4溶液褪色的物质是[ ]A.SO2B.FeSO4C.甲烷D.乙烯
- 下列化合物中,不能通过两种单质直接化合制取的是[ ]A.FeCl3B.CuCl2C.HClD.FeCl2
- 含有a mol FeBr2的溶液中,通入xmol Cl2。下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是[ ]A.x=0.4a...
- A、B、C、D、E五种物质均含有同一种元素,它们之间有如下转化关系(1)若A为单质,B、C均属于盐类,B的水溶液呈酸性,C的水溶液...
- 下列各物质的转化关系如下图所示,其中A是一种高熔点固体,D是一种棕红色固体。回答下列问题(1)C的化学式为______________...
- “材料”的发现和使用往往会极大地推动生产、生活的发展,一些材料的出现甚至具有里程碑式划时代的意义.请你回答以下问题:(1...
- 已知稀溴水和氯化铁溶液都呈黄色,现在足量的稀氯化亚铁溶液中,加入1~2滴液溴,振荡后溶液呈黄色。(1)甲同学认为这不是发...
- 现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全...
- 下列有关说法正确的是[ ]A.所有氧化还原反应都能自发进行B.Fe(NO3)2溶液中加入硝酸,可以抑制二价铁离子水解C.稀硝酸和稀...
- 根据下图中的反应,写出各物质的化学式及①②③反应的化学方程式。(1)A是________,B是________,C是________,D是________。(2)...