本试题 “化学键的键能是指气态原子间形成1mol化学键时释放的能量。如H(g)+I(g)→H-I(g) △H =+297kJ/mol即H-I键的键能为297kJ.mol-1,也可以理解为破坏1mol H-I键需要...” 主要考查您对键能、键长、键角
化学键与化学反应中能量变化的关系
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 键能、键长、键角
- 化学键与化学反应中能量变化的关系
共价键的键参数:
(1)键能:指气态基态原子形成1mol化学键释放的最低能量。键能越大,化学键越稳定。
(2)键长:指成键原子的核间距。键长越短,共价键越稳定。
注意:我们通常通过比较两原子的共价半径来比较共价单键键长的大小,但共价键的键长并不等于两原子的共价半径之和。
(3)键角:在多原子分子内,两个共价键之间的夹角。
键角是描述分子立体结构的重要参数。多原子分子的键角是一定的,表明共价键具有方向性。

说明:键长、键能决定共价键的强弱和分子的稳定性。原子半径越小,键长越短,键能越大,分子越稳定。例如, 分子中:
分子中:
X原子半径: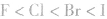
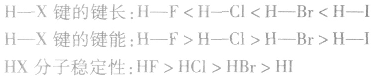
(1)键能:指气态基态原子形成1mol化学键释放的最低能量。键能越大,化学键越稳定。
(2)键长:指成键原子的核间距。键长越短,共价键越稳定。
注意:我们通常通过比较两原子的共价半径来比较共价单键键长的大小,但共价键的键长并不等于两原子的共价半径之和。
(3)键角:在多原子分子内,两个共价键之间的夹角。
键角是描述分子立体结构的重要参数。多原子分子的键角是一定的,表明共价键具有方向性。

说明:键长、键能决定共价键的强弱和分子的稳定性。原子半径越小,键长越短,键能越大,分子越稳定。例如,
 分子中:
分子中: X原子半径:
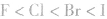
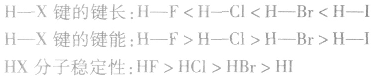
化学键与化学反应中能量变化的关系:
断开化学键要吸收能量,形成化学键要释放能量,通过化学键的键能可以计算断开化学键或形成化学键所需的能量。
反应热与键能的关系:
化学反应的热效应来源于化学反应过程中断裂旧化学键并形成新化学键时的能量变化。当破坏旧化学键所吸收的能量小于形成新化学键所释放的能量时,为放热反应;
当破坏旧化学键所吸收的能量大于形成新化学键所释放的能量时,为吸热反应。

若 反应为放热反应;若
反应为放热反应;若 或
或 ,反应为吸热反应。
,反应为吸热反应。
断开化学键要吸收能量,形成化学键要释放能量,通过化学键的键能可以计算断开化学键或形成化学键所需的能量。
反应热与键能的关系:
化学反应的热效应来源于化学反应过程中断裂旧化学键并形成新化学键时的能量变化。当破坏旧化学键所吸收的能量小于形成新化学键所释放的能量时,为放热反应;
当破坏旧化学键所吸收的能量大于形成新化学键所释放的能量时,为吸热反应。

若
 反应为放热反应;若
反应为放热反应;若 或
或 ,反应为吸热反应。
,反应为吸热反应。 发现相似题
与“化学键的键能是指气态原子间形成1mol化学键时释放的能量。如H...”考查相似的试题有:
- (5分)根据要求回答下列问题:①CaBr2 ②H2O ③NH4Cl ④H2O2 ⑤Na2O2 ⑥Ca(OH)2 ⑦HClO ⑧I2 ⑨He ⑩ Al(1)只含有离子键的是(用序号...
- 某元素的原子最外层只有一个电子,它跟卤族元素结合时形成的化学键A.一定是共价键B.一定是离子键C.可能是共价键,也可能是...
- 含下列化学键的物质,可能为单质的是( )A.只有离子键的物质B.既有离子键,又有非极性键的物质C.既有极性键,又有离子键...
- 下列各项中前后两个叙述都正确的是 ( )A.单质分子中一定存在共价键;最外层有2个电子的原子都是金属原子B.非极性键可以存...
- 现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E是同族元素,且D最外层电子数是次外层电子数的3倍。A、B...
- 下列各说法中正确的是( )。A.分子中键能越大,键长越长,则分子越稳定B.元素周期表中的ⅠA族(除H外)和ⅦA族元素的原子间...
- 以下有关杂化轨道的说法中错误的是( )A.ⅠA族元素成键时不可能有杂化轨道B.杂化轨道既可能形成σ键,也可能形成π键C.孤对电...
- 下列不属于配合物的是( )A.[Cu(H2O)4]SO4·H2OB.[Ag(NH3)2]OHC.KAl(SO4)2·12H2OD.Na[Al(OH)4]
- 下列有关热化学方程式的叙述中,正确的是A.含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则表示该反应中和热的...
- 下列用电子式表示物质的形成过程中正确的是( )A.Na·+→[Na]+[]-B.C.Na·++·Na→Na+[]2-Na+D.