本试题 “有M、R两种主族元素,已知R2-离子与M+离子核外电子数之和为20,则下列说法中不正确的是[ ]A.R与M的质子数之差可能等于7B.R与M的质子数之和一定等于19C.若R...” 主要考查您对原子核的组成及组成粒子间的关系
元素周期表
极性键、非极性键
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 原子核的组成及组成粒子间的关系
- 元素周期表
- 极性键、非极性键
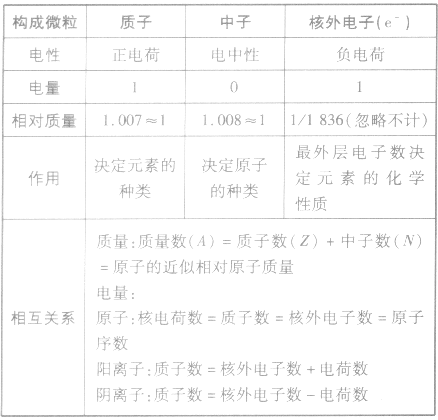
构成原子的三种微粒的比较:
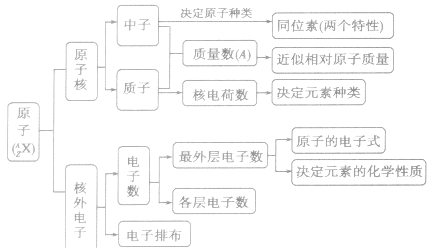
原子的构成:
元素周期表编排原则:
(1)把电子层数相同的各种元素按原子序数递增的顺序从左至右排成横行。
(2)把最外层电子数相同的元素按电子层数递增的顺序由上到下排列成纵行。
注意:①元素周期表是元素周期律的具体表现形式,它反映了元素之间相互联系的规律。
②历史上第一个元素周期表是1869年俄国化学家门捷列夫在前人探索的基础上排成的,他将元素按相对原子质量由小到大依次排列,并将化学性质相似的元素放在一个纵行。
元素周期表的结构:
(1)周期
①周期的含义在元素周期表中,把电子层数相同的元素,按原子序数递增的顺序从左到右排成横行,这样每个横行为一个周期。现在使用的元素周期表有7个横行,即7 个周期。
②周期的划分
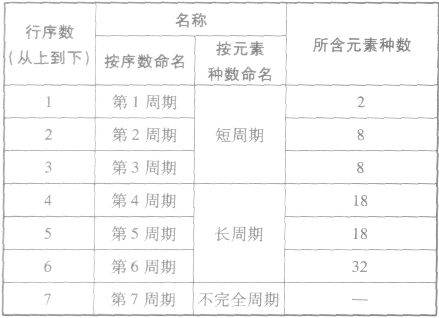
(2)族
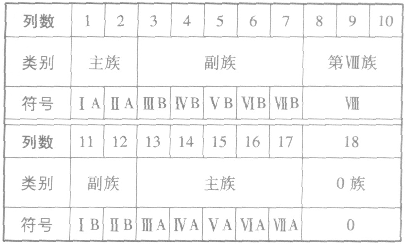
①族的含义在周期表中,把不同横行(即周期)中最外层电子数相同的元素,按电子层数递增的顺序由上到下排成纵行,除第8、9、10三个纵行叫做第Ⅷ族外,其余15个纵行,每个纵行为一族。现在使用的元素周期表有18 个纵行,它们被划分为16个族。
②族的划分
(3)元素周期表中主族元素金属性和非金属性的递变
(1)非极性键:同种元素的原子间形成的共价键(共用电子对不偏移,成键原子双方不显电性)。
如:在非金属单质(H2 Cl2 O2)、共价化合物(H2O2 多碳化合物)、离子化合物(Na2O2 CaC2)中存在。
(2)极性键:不同元素的原子间形成的共价键(共用电子对偏向吸引电子能了强的一方,该元素显负价,偏离吸引电子能力弱的一方,该元素显正价)。如:在共价化合物(HCl H2O CO2 NH3)、某些离子化合物(NaOH Na2SO4 NH4Cl)中存在。
分子空间构型、键的极性与分子的极性:

化学键与物质类别:
1.只含有极性共价键的物质:一般是不同非金属元素构成的共价化合物。例如: 等。
等。
2.只含非极性共价键的物质:同种非金属元素构成的单质。例如: 、金刚石等。
、金刚石等。
3.既有极性键又有非极性键的物质。例如: 等。
等。
4.只含有离子键的物质:活泼非金属元素与活泼金属元素形成的化合物。例如: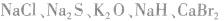 等。
等。
5.既有离子键又有非极性键的物质。例如: 等。
等。
6.既有离子键又有极性键的物质。例如: 等。
等。
7.由离子键、共价键、配位键构成的物质。例如: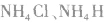 等。
等。
8.只含有共价键而无范德华力的物质。例如:金刚石、晶体硅、 等原子晶体。
等原子晶体。
9.由强极性键构成但又不是强电解质的物质。例如:HF。
10.没有化学键的物质。例如:稀有气体(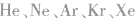 等)。
等)。
与“有M、R两种主族元素,已知R2-离子与M+离子核外电子数之和为20...”考查相似的试题有:
- 化学用语是学习化学的重要工具。以下化学用语表示正确的是[ ]A.NaCl既能表示物质的组成,又能表示物质的分子式B.16O与18O互...
- 下列各组指定原子序数的元素,不能形成AB2型化合物的是( )A.6和8B.16和8C.12和9D.11和6
- 国际无机化学命名委员会在1989年做出决定,把元素周期表原先的主、副族及族号取消,由左至右改为18列。如碱金属元素为第1列,...
- 全国科学技术名词审定委员会于2007年3月21日宣布:lll号元素(符号为Rg)的中文名称为“錀”(读音为伦).下列说法正确的是( ...
- 在第三周期中,置换氢气能力最强的元素的符号为______,化学性质最稳定的元素的符号是______,最高价氧化物的水化物酸性最强...
- 元素周期表的过渡金属中能找到( )A.新制农药元素B.强氧化剂C.制半导体元素D.制耐高温合金元素
- [三选一—选修3:物质结构与性质]X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的...
- 元素的原子结构决定其性质和周期表中的位置。下列叙述正确的是[ ]A.元素原子的最外层电子数等于元素的最高化合价B.多电子原...
- 外围电子构型为4f75d16s2元素在周期表中的位置是[ ]A.四周期ⅦB族B.五周期ⅢB族C.六周期ⅦB族D.六周期ⅢB族
- 将下列粒子的符号填入相应的空格内:O2、NH3、CO2、H2O、N2、(NH4)2SO4、SiCl4。(1)存在极性键的极性分子是____。(2)存在非极...