本试题 “对下列实验中出现的异常现象分析合理的是( )A.制取CO2气体时,始终收集不到CO2--收集CO2的集气瓶没盖严B.加热碱式碳酸铜固体粉末时,试管破裂--加热前没...” 主要考查您对物质的加热
二氧化碳的制取和收集
空气的成分
氧气的性质
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 物质的加热
- 二氧化碳的制取和收集
- 空气的成分
- 氧气的性质
物质加热的方法:
1、加热时,受热容器外壁不能含水,以防止受热不均而破裂。
2、操作时,先要来回移动使试管均匀受热(预热),以防局部受热而使试管破裂。
3、对盛有液体的试管加热,要使管口向斜上方倾斜(约45°角),不得将试管口对人,以防液体喷出试管口而伤人。
4、加热时,还要不断振荡试管,以防止局部受热沸腾而飞溅。
液体物质的加热:
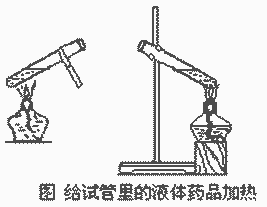
1、液体体积不超过试管容积的1/3;
2、试管外壁必须擦干;
3、加热前要预热,用外焰加热;
4、试管与桌面成45。,管口不得对人。
固体物质的加热:
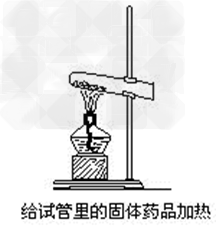
1、加热前需先将试管外壁擦干;
2、试管口要稍向下倾斜;
3、要先均匀预热,再集中在盛固体部位加热;
4、加热过程中,不要让试管跟灯芯接触,以免试
管炸裂。
问答点拨:
1、加热试管里的液体时,能否将试管口对着人?
答:不能。不得将试管对着人,以防液体喷出试管口而伤人。
2、如果试管外壁有水的话,能否直接加热?
答:不能。加热时,试管外壁不能有水,以防止试管受热不均而破裂。
3、液体沸腾时的试管,能否立即用冷水冲洗?
答:不能。热试管骤冷会破裂。
4、如何给试管中的液体进行预热?
答:手持试管夹在酒精灯火焰外焰处来回移动试管,如果试管固定可以左右移动酒精灯。
水浴加热:
(1)什么是水浴加热把要加热的物质放在水中,通过给水加热达到给物质加热的效果。一般都是把要反应的物质放在试管中,再把试管放在装有水的烧杯里,再在烧杯中插一根温度计,控制反应的温度。
(2)水浴加热的优点水浴加热可以避免直接加热造成的过度剧烈和温度的不可控制性,可以平稳均匀的加热,许多反应需要严格控制温度,就需要水浴加热。
使用酒精灯时,要注意以下几点:
(1)酒精灯内的酒精不超过容积的2/3,不得少于容积的1/4 ;
(2)点燃酒精灯时先用镊子调节灯芯高低、 平整,再点燃;
(3)绝对禁止向燃着的酒精灯内添加酒精;
(4)绝对禁止用燃着的酒精灯引燃另一盏酒精灯,以免引起火灾;
(5)用完酒精灯后必须用灯帽盖灭,不可用嘴去吹灭;
(6)不要碰倒酒精灯,万一洒出的酒精在桌面燃烧,应立刻用湿抹布扑灭 。
常见仪器的耐热性:
试管、坩埚、蒸发皿,直接加热不用问。烧杯、烧瓶、锥形瓶,石棉网下酒精灯。量筒、水槽、集气瓶,不可受热记在心。
给物质加热的注意事项:
给物质加热时,若被加热的玻璃容器外壁有水,应擦干再加热,以免容器炸裂;加热时玻璃容器底部不能跟灯芯接触,也不能离得太远;烧得很热的玻璃容器,不要立即用冷水冲洗(以免容器炸裂),也不要直接放在实验台上 (防止烫坏实验台),要垫上石棉网。
二氧化碳的制取和收集:
1.原理和药品:CaCO3 + 2HCl === CaCl2 + H2O + CO2↑
2.装置:固液混合不加热
(1)发生装置
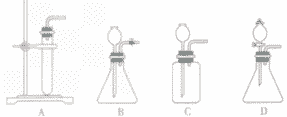
A装置为简易装置,不便于加液体;
B,C使用了长颈漏斗,便于添加液体,使用B、C装置时应注意,长颈漏斗下端管日应伸入液面以下,防止产生的气体从长颈漏斗逸出;
D装置使用了分液漏斗,便于加酸,还可以利用活塞控制反应。
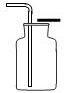
(2)收集装置:二氧化碳溶于水,所以不能用排水法收集;其密度比空气大,所以可采用向上排空气法收集。
如图:
3.现象:块状固体不断溶解,产生大量气泡。
4.检验:把产生的气体通入澄清石灰水,若澄清石灰水变浑浊,证明是二氧化碳。
5.验满:将燃着的木条放在集气瓶口,如果木条的火焰熄灭,证明已集满。
6.实验步骤
a.检查装置的气密性;
b.装入石灰石(或大理石);
c. 塞紧双孔塞;
d.从长颈漏斗中加入稀盐酸;
e.收集气体;
f.验满。
7.注意事项:反应物不能用浓盐酸、硫酸、因为浓盐酸易挥发,会挥发出氯化氢气体,使制得的二氧化碳不纯;硫酸不会挥发,但会生成硫酸钙沉淀,沉淀的硫酸根附着在碳酸钙(或石灰石)表面,使碳酸钙(或石灰石)与酸的接触面积变小,最后反应停止!
实验室制取二氧化碳的选择:
实验室用大理石或石灰石(主要成分是碳酸钙)和稀盐酸制取二氧化碳。
注意:
(1)不能选用稀硫酸,因为稀硫酸与碳酸钙反应生成微溶于水的硫酸钙会橙盖在碳酸钙的表面,阻止反应继续进行。
(2)不能选用浓盐酸,因为浓盐酸易挥发,得不到纯净的二氧化碳气体。
(3)不能用碳酸钠代替石灰石,因为反应太剧烈,产生的气体难以收集。反应速率的快慢与反应物的质量分数和接触面积有关。反应物的接触面积越大,反应物的质量分数越大,反应速率就越快,反之,则越慢。
各组物质反应情况如下表所示:
| 药品 | 反应速率 |
| 块状石灰石和稀盐酸 | 产生气泡速率适中 |
| 石灰石粉末和稀盐酸 | 产生气泡速率很快 |
| 块状石灰石和稀硫酸 | 产生气泡速率缓慢并逐渐停止 |
| 碳酸钠粉末和稀盐酸 | 产生气泡速率很快 |
氧气,二氧化碳,氢气,氮气,稀有气体;按体积分:N2占78%,O2占21%,稀有气体占0.94%,二氧化碳占0.03%,其他气体和杂质占0.03%。
易错点:
空气中各成分的含量在一定时间和一定范围内基本恒定,但随着人类活动的延续,气体的排放,空气的成分也在不停地变化,因此不能认为空气的成分是一成不变的。
氧气,空气主要组分之一,比空气重,标准状况(0℃和大气压强101325帕)下密度为1.429克/升。无色、无臭、无味。在水中溶解度很小。压强为101kPa时,氧气在约-183摄氏度时变为淡蓝色液体,在约-218摄氏度时变成雪花状的淡蓝色固体。
氧气的性质:
1.氧气的物理性质:
(1)无色无味,标况下,氧气的密度为1.429g/L,密度比空气大,难溶于水,1L水中只能溶解约30ml的氧气。
(2)三态变化:氧气(无色气体)
 液氮(淡蓝色液体)
液氮(淡蓝色液体) 固态氮(淡蓝色雪花状)
固态氮(淡蓝色雪花状)(3)工业产生的氧气,一般加压贮存在蓝色的钢瓶中。
2.氧气的化学性质:
(1)化学性质较活泼,在一定条件下,可以和多种物质发生化学反应,同时放出热量;具有助燃性和氧化性,在化学反应中提供氧,是一种常用的氧化剂。
(2)助燃性,氧化性
①与金属的反应:
2Mg+O2
 2MgO
2MgO3Fe+2O2
 Fe3O4
Fe3O4②与非金属的反应:
C+O2
 CO2(O2充分)
CO2(O2充分)2C+O2
 2CO(O2不充分)
2CO(O2不充分)③与化合物的反应:
2CO+O2
 2CO2
2CO2CH4+2O2
 CO2+2H2O
CO2+2H2OC2H5OH+3O2
 2CO2+3H2O
2CO2+3H2O易错点:
(1)误认为氧气具有可燃性,可以做燃料
氧气可以帮助可燃物燃烧,具有助燃性,它本身不能燃烧,不能做可燃物。
(2)误认为氧气的化学性质非常活泼,能与所有物质发生反应
氧气是一种化学性质非常活泼的气体,在一定条件下能与许多物质发生化学反应,但不是与所有物质都能发生化学反应。
(3)误认为燃烧都需要氧气
燃烧有广义和狭义之分,通常所说的燃烧是指可燃物与氧气发生的一种发光,放热的剧烈的氧化反应。燃烧的条件之一是需要氧气。但有一些燃烧不需要氧气,如镁在二氧化碳中也能燃烧。
(4)误认为物质与氧气的反应叫氧化反应
氧化反应是物质与氧发生的反应,其中包括物质与氧气中的氧元素发生的反应,也包括物质与其他含氧物质中的氧元素发生的反应。如氢气与氧气反应生成水是氧化反应,氢气与氧化铜反应生成铜和水也是氧化反应。
(5)误认为氧气与液氧性质不行
物质的性质包括物理性质和化学性质,氧气与液氧物理性质不同,但化学性质是相同的,因为它们二者的分子构成相同,都是由氧分子构成的。
(6)误认为含氧的物质都能制取氧气。
制取氧气需要含氧的物质,但不是所有的含氧物质都能用来制取氧气。
与“对下列实验中出现的异常现象分析合理的是( )A.制取CO2气体...”考查相似的试题有:
- 氧气和二氧化碳是同学们熟悉的气体,实验室制取这两种气体时一定相同的是( )A.反应原理B.发生装置C.收集装置D.集满气体...
- 为了研究CO2的性质,需要制取并收集CO2气体.以下是老师提供的一些实验装置.(1)制取并收集CO2气体,可采用的装置组合是___...
- (12分)用加热高锰酸钾的方法制取氧气,部分实验操作和实验装置如下图所示。请回答下列问题: A B C D(1)检验装置气密性的...
- 如图1是初中实验常见装置,请回答:(1)写出图中标号为a、b的仪器名称:a ;b .(2)实验室中用过氧化氢溶液和二氧化锰混合...
- 请根据下列实验装置回答问题。 A B C D E F G H (1)写出标有序号的仪器名称:a______________,b______________。(2)在实验...
- 下列关于空气的说法中,正确的是[ ]A.空气中还有很多物质,其中只有氧气是有用的,其他是有害的B.空气中只有氧气能提供呼吸,...
- 资源是宝贵的财富,下列有关资源的说法不正确的是( )A.地球上可利用的淡水资源不到全球水储量的l%B.宝贵的金属资源主要分...
- 空气中氮气与氧气的体积比接近( )A.5:1B.1:5C.4:1D.1:4
- 构建知识网络是一种重要的学习方法,下图是关于A物质的知识网络,A、B、C、D、E都含有同一种元素,其中B为黑色单质,E为大理...
- 按题意从N2、O2、CO2、CO、CH4中选择适宜的化学式填空:①有剧毒的是 ;②能助燃的是 ;③空气中含量最多的是 ;④在空气中可以燃...