本试题 “请结合下列装置图完成问题:(1 )写出上图中带有标号仪器的名称:a__________,b__________ 。(2)实验室制取氧气、氢气、二氧化碳气体时,选用A 、E 装置可...” 主要考查您对常用仪器的名称和选用
氢气的制取和收集
二氧化碳的制取和收集
S,Fe,C,P等物质在氧气中的燃烧
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 常用仪器的名称和选用
- 氢气的制取和收集
- 二氧化碳的制取和收集
- S,Fe,C,P等物质在氧气中的燃烧
试管、烧杯、蒸发皿、坩埚、酒精灯、漏斗、洗气瓶、干燥管、
托盘天平、量筒、容量瓶、滴定管、玻璃棒、量气装置等。
常用仪器对比分析:
|
常见的化学仪器 |
主要用途 | ||
|
分类 |
名称 |
图示 | |
| 用于加热仪器 | 试管 |  |
(1)用作少量试剂的反应容器,在常温或加热时使用 (2)作为小型气体发生器 (3)收集少量气体 |
| 蒸发皿 |  |
用于溶液的蒸发、浓缩 | |
| 燃烧匙 |  |
用于盛放可燃性固体物质进行燃烧实验 | |
| 烧杯 |  |
(1)溶解物质配制溶液 (2)较大量试剂反应容器 (3)常温或加热使用 | |
| 锥形瓶,烧瓶(圆底,平底) | 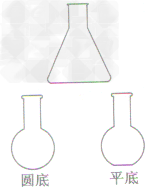 |
(1)用作较大量液体反应的容器和气体发生装置,在常温或加热时使用 (2)锥形瓶是蒸馏的接收容器 | |
| 酒精灯 |  |
用于加热 | |
| 盛放物质的仪器 | 集气瓶 |  |
(1)收集和储存少量气体 (2)进行物质和气体之间的反应 |
| 滴瓶,滴管 |  |
滴瓶用于盛放少量液体试剂 | |
| 细口瓶 |  |
储存液体药品 | |
| 广口瓶 | 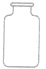 |
储存固体药品 | |
| 计量仪器 | 托盘天平 | 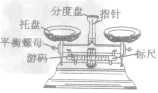 |
称量物质的质量(精确度为0.1g) |
| 量筒 |  |
量取一定体积的液体或间接测量气体的体积 | |
| 漏斗 | 普通漏斗 |  |
过滤,注入液体 |
| 长颈漏斗 |  |
用于注入液体 | |
| 分液漏斗 |  |
(1)注入液体 (2)分液漏斗用于分离两种密度不同且互不相溶的液体 | |
| 夹持仪器 | 铁架台 |  |
固定和放置各种仪器 |
| 试管夹 |  |
夹持试管进行简单的加热试验 | |
| 坩埚钳 |  |
夹持坩埚或夹持热的蒸发皿等 | |
| 辅助仪器 | 水槽 |  |
排水集气 |
| 药匙 |  |
取用固体药品(粉末状或小颗粒状) | |
| 玻璃棒 | 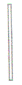 |
搅拌液体,引流,沾取液体 | |
| 石棉网 |  |
用于烧杯或烧瓶加热时垫在底部,使仪器受热均匀 | |
| 试管刷 |  |
用于刷洗试管等玻璃仪器 | |
| 温度计 |  |
用于测量温度 | |
实验室里通常用稀硫酸跟金属锌起反应来制取氢气,也可以用盐酸代替硫酸,用镁或铁代替锌来制取氢气。
氢气的实验室制法:
| 化学药品 | 锌粒和稀硫酸 |
| 反应原理 | Zn + H2SO4== ZnSO4+ H2↑ |
| 发生装置 | 反应物状态为固态和液态,反应条件为室温,可选择实验室制CO2的反应装置(或用过氧化氢溶液制氧气的反应装置)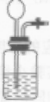 |
| 收集装置 | 向下排空气法或排水法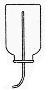  |
| 实验步骤 | ①检验装置的气密性 ②装锌粒(注意将试管横放,把锌粒放入试管口,再慢慢竖起) ③把试管固定在铁架台上 ④加入稀硫酸 ⑤收集气体 |
| 注意事项 | ①不能用浓H2SO4代替稀H2SO4,浓H2SO4具有强氧化性 ②不能用金属活动性顺序表中排在氢后面的金属,如铜,也不能用排在氢前的金属,如钠,一般常用Zn、Al、Fe、Mg等。 ③长颈漏斗末端应在液而以下,防止氢气从长颈漏斗逸出 |
氢气的工业制法:
| 制取方法 | 原理 | 优缺点 |
| 电解水 | 2H2O 2H2↑+O2 2H2↑+O2 |
优点:得到氢气纯度高 缺点:耗能高 |
| 水煤气 | C+H2O(g) CO+H2 CO+H2 |
优点:成本低 缺点:需要设备多(需要除去CO中的杂质) |
| 天然气 | CH4 C+2H2 C+2H2 |
优点:原料丰富 缺点:氢气纯度低 |
| 电解饱和食盐水 | 2NaCl+2H2O 2NaOH+H2↑+Cl2↑ 2NaOH+H2↑+Cl2↑ |
优点:是氯碱化工的副产品 缺点:纯度低 |
| 理想模式:利用太阳能、高效催化剂分解水 | 2H2O 2H2↑+O2↑ 2H2↑+O2↑ |
优点:不耗费电能、热能,环保 缺点:人类未能寻找到高效催化剂,还未能实际应用 |
二氧化碳的制取和收集:
1.原理和药品:CaCO3 + 2HCl === CaCl2 + H2O + CO2↑
2.装置:固液混合不加热
(1)发生装置
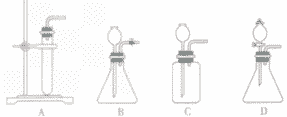
A装置为简易装置,不便于加液体;
B,C使用了长颈漏斗,便于添加液体,使用B、C装置时应注意,长颈漏斗下端管日应伸入液面以下,防止产生的气体从长颈漏斗逸出;
D装置使用了分液漏斗,便于加酸,还可以利用活塞控制反应。
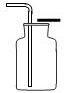
(2)收集装置:二氧化碳溶于水,所以不能用排水法收集;其密度比空气大,所以可采用向上排空气法收集。
如图:
3.现象:块状固体不断溶解,产生大量气泡。
4.检验:把产生的气体通入澄清石灰水,若澄清石灰水变浑浊,证明是二氧化碳。
5.验满:将燃着的木条放在集气瓶口,如果木条的火焰熄灭,证明已集满。
6.实验步骤
a.检查装置的气密性;
b.装入石灰石(或大理石);
c. 塞紧双孔塞;
d.从长颈漏斗中加入稀盐酸;
e.收集气体;
f.验满。
7.注意事项:反应物不能用浓盐酸、硫酸、因为浓盐酸易挥发,会挥发出氯化氢气体,使制得的二氧化碳不纯;硫酸不会挥发,但会生成硫酸钙沉淀,沉淀的硫酸根附着在碳酸钙(或石灰石)表面,使碳酸钙(或石灰石)与酸的接触面积变小,最后反应停止!
实验室制取二氧化碳的选择:
实验室用大理石或石灰石(主要成分是碳酸钙)和稀盐酸制取二氧化碳。
注意:
(1)不能选用稀硫酸,因为稀硫酸与碳酸钙反应生成微溶于水的硫酸钙会橙盖在碳酸钙的表面,阻止反应继续进行。
(2)不能选用浓盐酸,因为浓盐酸易挥发,得不到纯净的二氧化碳气体。
(3)不能用碳酸钠代替石灰石,因为反应太剧烈,产生的气体难以收集。反应速率的快慢与反应物的质量分数和接触面积有关。反应物的接触面积越大,反应物的质量分数越大,反应速率就越快,反之,则越慢。
各组物质反应情况如下表所示:
| 药品 | 反应速率 |
| 块状石灰石和稀盐酸 | 产生气泡速率适中 |
| 石灰石粉末和稀盐酸 | 产生气泡速率很快 |
| 块状石灰石和稀硫酸 | 产生气泡速率缓慢并逐渐停止 |
| 碳酸钠粉末和稀盐酸 | 产生气泡速率很快 |
氧化的化学性质很活泼,很多物质都能与氧气发生化学反应。
部分物质在空气中和氧气中反应的对比:
a)碳和氧气反应
方程式:C + O2 CO2
CO2
现象:剧烈燃烧,发白光,放热,生成使澄清石灰水变浑浊的气体
b)硫和氧气反应
方程式:S + O2 SO2
SO2
现象:发出明亮的蓝紫色火焰,放热,生成有刺激性气味的气体
注意:实验前应在瓶底放少量水,用来吸收生成的有毒气体。
c)红磷和氧气反应:
方程式:4P + 5O2 2P2O5
2P2O5
现象:发出耀眼的白光,放热,生成大量白烟
生成的P2O5是固体小颗粒,现象为白烟,不是白雾。
d)铁和氧气的反应:
方程式:3Fe + 2O2 Fe3O4
Fe3O4
现象:剧烈燃烧,火星四射,放出热量,生成黑色物质
注意:集气瓶底放一层细沙或少量水。
e)镁和氧气反应:
方程式:2Mg + O2 2MgO
2MgO
现象:剧烈燃烧,发出耀眼的白光,放出热量,生成白色粉末状固体,有白烟。
注意:不能手持镁条,应用坩埚钳夹持。
f)石蜡和氧气反应
文字表达式:石蜡+氧气 水+二氧化碳
水+二氧化碳
现象:剧烈燃烧,放出热量,发出白光,如果在火焰上方罩一个干冷烧杯,
烧杯内壁有水珠,生成使澄清石灰水变浑浊的气体。
烟和雾的区别:
a)烟:大量固体小颗粒分散在空气长产生烟。红磷燃烧产生大量白烟,是燃烧生成的固体P2O5分散在空气中形成的
b)雾:大量小液滴分散在气体中产生雾。打开盛浓盐酸的瓶塞,瓶口有白雾,是挥发的HCl气体遇到空气中的水蒸气形成了盐酸小液滴。
a)光:固体物质燃烧使发光。镁条燃烧发出耀眼的强光,木炭在氧气中燃烧产生白光
b)气体物质和容易气化的物质燃烧时产生火焰。蜡烛在氧气中燃烧产生白色的火焰,是石蜡熔化后生成的气体燃烧而产生的。
描述物质在氧气中燃烧的现象的技巧:
可按三个顺序从三个方面进行:
(1)剧烈燃烧,有什么颜色的光,火焰;
(2)放热;
(3)生成物的特性
与“请结合下列装置图完成问题:(1 )写出上图中带有标号仪器的...”考查相似的试题有:
- 化学小组的同学来到实验室,实验桌上摆放有下列仪器:(1)f仪器的名称是 。(2)用高锰酸钾制取氧气还需要补充的玻璃仪器是 ...
- (12分)根据下图实验装置进行回答:A B C D E F(1)写出标号仪器的名称:① ② ③ ④ (2)若要制取并收集较纯的氧气,则需 和 ...
- 结合下列图示装置,回答有关问题:(1)写出图中的仪器名称:①是 、②是 。(2)利用高锰酸钾制取氧气的化学方程式为 ,利用该...
- (5分)某班学生参加了化学实验技能考查。(1)小虎抽到的题目是“氧气的实验室制法——用加热高锰酸钾的方法制取氧气”。A B C D...
- 请你根据下图回答下列问题:(1)指出上面编号仪器的名称:H_________、I__________;(2)用D装置收集某种气体时,如何判断...
- 实验室常用下列装置来制取气体: (1)写出图中有标号仪器的名称:a 、b ;(2)用双氧水和二氧化锰来制取氧气时,发生反应的...
- 右图提到的“低碳生活”是指生活中要减少能量消耗,从而降低碳特别是二氧化碳的排放。下列做法不属于“低碳生活”方式的是A.经常...
- 下列实验现象叙述错误的是[ ]A、硫在氧气中燃烧产生蓝紫色的火焰B、铁在氧气中燃烧时,火星四射、放出大量的热、生成黑色固体...
- 下列实验现象描述不正确的是[ ]A.红磷燃烧产生大量的白烟B.硫在空气中燃烧,产生淡蓝色火焰C.过氧化氢溶液中滴加硫酸铜溶...
- 图1装置是实验室制取气体时常用到的仪器,请回忆我们进行分组实验时的情景,回答下列问题.(1)小丽要用高锰酸钾制取氧气,...