二氧化碳的制取和收集:
1.
原理和药品:CaCO
3 + 2HCl === CaCl
2 + H
2O + CO
2↑
2.
装置:固液混合不加热
(1)发生装置
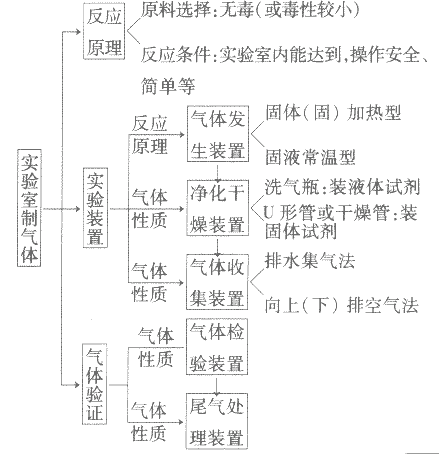
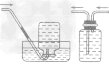
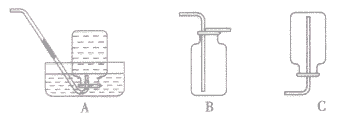
A装置为简易装置,不便于加液体;
B,C使用了长颈漏斗,便于添加液体,使用B、C装置时应注意,长颈漏斗下端管日应伸入液面以下,防止产生的气体从长颈漏斗逸出;
D装置使用了分液漏斗,便于加酸,还可以利用活塞控制反应。
(2)收集装置:二氧化碳溶于水,所以不能用排水法收集;其密度比空气大,所以可采用向上排空气法收集。
如图:
3.
现象:块状固体不断溶解,产生大量气泡。
4.
检验:把产生的气体通入澄清石灰水,若澄清石灰水变浑浊,证明是二氧化碳。
5.
验满:将燃着的木条放在集气瓶口,如果木条的火焰熄灭,证明已集满。
6.
实验步骤 a.检查装置的气密性;
b.装入石灰石(或大理石);
c. 塞紧双孔塞;
d.从长颈漏斗中加入稀盐酸;
e.收集气体;
f.验满。
7.
注意事项:反应物不能用浓盐酸、硫酸、因为浓盐酸易挥发,会挥发出氯化氢气体,使制得的二氧化碳不纯;硫酸不会挥发,但会生成硫酸钙沉淀,沉淀的硫酸根附着在碳酸钙(或石灰石)表面,使碳酸钙(或石灰石)与酸的接触面积变小,最后反应停止!
实验室制取二氧化碳的选择:
实验室用大理石或石灰石(主要成分是碳酸钙)和稀盐酸制取二氧化碳。
注意:
(1)不能选用稀硫酸,因为稀硫酸与碳酸钙反应生成微溶于水的硫酸钙会橙盖在碳酸钙的表面,阻止反应继续进行。
(2)不能选用浓盐酸,因为浓盐酸易挥发,得不到纯净的二氧化碳气体。
(3)不能用碳酸钠代替石灰石,因为反应太剧烈,产生的气体难以收集。反应速率的快慢与反应物的质量分数和接触面积有关。反应物的接触面积越大,反应物的质量分数越大,反应速率就越快,反之,则越慢。
各组物质反应情况如下表所示:
| 药品 |
反应速率 |
| 块状石灰石和稀盐酸 |
产生气泡速率适中 |
| 石灰石粉末和稀盐酸 |
产生气泡速率很快 |
| 块状石灰石和稀硫酸 |
产生气泡速率缓慢并逐渐停止 |
| 碳酸钠粉末和稀盐酸 |
产生气泡速率很快 |
实验室制取气体的思路: 1.知识要点详解在初中化学中,主要应掌握O
2、H
2、CO
2的实验室制法。可以从制备所需仪器、药品、反应原理、收集方法、实验装置、验满、验纯及操作要点等方面进行比较。通过比较,能够总结和归纳实验室制取气体的思路。即:研究反应原理一根据所选药品的状态和反应条件,选择适当的仪器组成相应的实验装置一根据实验装置的特点,设计合理的实验操作步骤,预测可能的注意事项一根据所制取气体的性质,选择相应的收集、检验、验满及验纯的方法。
实验室制取气体及验证其性质的实验,属于基本操作的简单综合实验。通过对比发生装置和收集装置,总结气体的个性及几种气体的共性,提高记忆效果。
2.设计装置的依据制取气体的装置分两部分:气体发生装置和气体收集装置。
发生装置的选取根据反应条件和反应物的状态而设计,收集装置是根据气体的性质(主要是物理性质)而确定的。
确定收集装置的原则——气体的收集方法是由该气体的性质,如密度、在水中的溶解性、是否与空气或水反应、是否有毒等决定的。
气体发生装置:
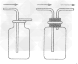
①“固+固

”的反应,简称“固体加热型”,装置如图A所示,如用KMnO
4或KClO
3和MnO
2制O
2。
②“固+液

”的反应,简称“固液常温型”,装置如图B、C、D、E。如用H
2O
2和MnO
2制O
2、用锌粒与稀H
2SO
4制H
2或用CaCO
3与稀盐酸制CO
2。同B装置相比,D装置具有便于添加液体药品,制取的气体量较多的优点;C装置不仅添加液体药品方便,而且可通过导管上的开关控制反应的发生和停止;E装置可通过分液漏斗的活塞控制加入药品的量和速度。

③“固+液

”的反应的发生装置的其他改进:
为了节约药品,方便操作,可设计如下图所示装置,这些装置都可自动控制。
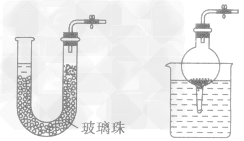
当打开弹簧夹时,溶液进入反应器内开始反应;当关闭弹簧夹时,气路不通,反应产生的气体将溶液压出反应器外,液体与同体分离,反应停止。
气体收集装置:
| 收集装置 |
 |
 |
 |
| 选择条件 |
难溶或微溶于水,与水不发生化学反应的气体。如:H2、 O2、CH4等 |
不与空气发生反应,密度比空气密度大的气体。如:O2、 CO2等 |
不与空气发生反应,密度比空气密度小的气体。如:H2、CH4等 |
| 说明 |
①使用排水法收集的气体较纯净,但缺点是会使收集的气体中禽有水蒸气。当导管口有连续均匀的气泡冒出时才开始收集,当有大量气泡从集气瓶口冒出时,表明气体已收集满。
②用向上排空气法收集气体,应注意将导管伸到接近集气瓶瓶底,同时应在瓶口盖上玻璃片,以便尽可能地排尽空气,提高所收集气体的纯度。使用排空气法收集的气体比较十燥,但纯度较低,需要验满(可燃性气体则要注意安全,点燃之前一定要验纯,否则有爆炸危险) |
药品的选取和实验方案的设计: (1)可行性:所选取的药品能制得要制取的气体;
(2)药品廉价易得;
(3)适宜的条件:要求反应条件易达到,便于控制;
(4)反应速率适中:反应速率不能太快或太慢,以便于收集或进行实验;
(5)气体尽量纯净;
(6)注意安全性:操作简便易行,注意防止污染。
例如:①实验室制取H
2时选用锌粒,而不用镁条、铁片,原因是镁价格贵且反应速率太快而铁反应速率又太慢;酸选用稀硫酸,而不宜用稀盐酸、浓硫酸,因为用稀盐酸制得的H
2,因混有HCl而不纯,而锌与浓硫酸反应不生成H
2.
②制CO
2时可选用用石灰石(或大理石)与稀盐酸,而不选用Na
2CO
3浓盐酸、稀硫酸,原因是Na
2CO
3,反应速率太快,浓盐酸易挥发出HCl气体,稀硫酸反应不能进行到底,也不能煅烧石灰石,因为条件不易达到,不呵操作;
④用KClO
3、过氧化氢制O
2时,要加少量的MnO
2,作催化剂,以加快反应的速率
实验室制取气体的实验操作程序:实验室制取气体存选择好药品、仪器后操作的一般程序:
(1)组装仪器:一般按从左到右,从下到上的顺序进行;
(2)检查装置气密;
(3)装药品:若是固体跟液体反应,一般是是先装入固体再加入液体;
(4)准备收集装置:若用排水法收集气体时,应在制取气体之前将集气瓶盛满水;
(5)制取气体;
(6)收集气体并验满;
(7)拆洗仪器。
注意:①给同体加热时.试管口要略向下倾斜;
②用加热KMnO
4或KClO
3(MnO
2作催化剂)的方法制取O
2,若用排水法收集,实验完毕时应先把导管移出水槽再移走酒精灯;
③固体跟液体反应制取气体时,要注意长颈漏斗末端要插入液面以下进行液封,以防漏气。
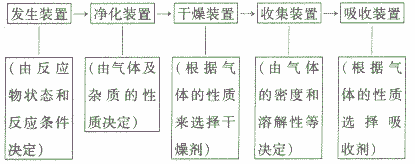
装置的选取与连接:实验室制取气体的实验往往与气体的净化、气体的干燥综合在一起。气体综合实验的装置选择及连接顺序为:
 气体净化的几种方法:
气体净化的几种方法: (1)吸收法:用吸收剂将杂质气体吸收除去。如除去CO中混有的少量CO
2,可先用浓NaOH溶液吸收CO
2,再用浓硫酸等干燥剂除去水蒸气。常用吸收剂如下表:
| 吸收剂 |
吸收的气体杂质 |
吸收剂 |
吸收的气体杂质 |
| 水 |
可溶性的气体:HCl,NH3 |
NaOH |
CO2,HCl,H2O |
| 无水CuSO4 |
H2O |
碱石灰 |
CO2,HCl ,H2O |
| 灼热的铜网 |
O2 |
NaOH |
CO2,HCl |
| 灼热的CuO |
H2,CO |
浓硫酸 |
H2O |
(2)转化法:通过化学反血,将杂质气体转化为所要得到的气体:如除去CO
2中的CO,可将混合气体通过足量的灼热CuO+CO

Cu+CO
2
气体的干燥:
气体的干燥是通过干燥剂来实现的,选择干燥剂要根据气体的性质。一般原则是:酸性干燥剂不能用来干燥碱性气体,碱性干燥剂不能用来干燥酸性气体,干燥装置由干燥剂的状念决定.
(1)常见的干燥剂
| 干燥剂 |
可干燥的气体 |
不可干燥的气体 |
| 名称或化学式 |
酸碱性 |
状态 |
| 浓H2SO4 |
酸性 |
液体 |
H2、N2、O2、CO2、HCl、CH4、CO |
NH3 |
| 固体NaOH、生石灰,碱石灰(氢氧化钠和生石灰的混合物) |
碱性 |
固态 |
H2、O2、N2、CH4、CO、NH3等 |
CO2、SO2、HCl |
| 无水CaCl2 |
中性 |
固态 |
除NH3外的所有气体 |
NH3 |
(2)干燥装置的选择
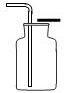
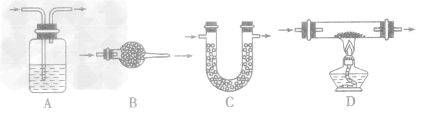
①除杂试剂为液体时,常选用洗气瓶,气体一般是 “长进短出”,如下图A。
②除杂试剂为同体时,常选用干燥管(球形或u 形),气体一般是“大进小出”,如下图B、C。
③需要通过加热与固体试剂发生化学反应除去的气体,常采用硬质玻璃管和酒精灯,如下图D。
 装置连接顺序的确定规律:
装置连接顺序的确定规律: (1)除杂和干燥的先后顺序
①若用洗气装置除杂,一般除杂在前,干燥在后。原因:从溶液中出来的气体通常混有水蒸气,干燥在后可将水蒸气完全除去。如除去CO中混有的CO
2和水蒸气,应将气体先通过。NaOH溶液,再通过浓H
2SO
4。
②若用加热装置除杂,一般是干燥在前,除杂在后。如除去CO
2中混有的CO和水蒸气,应将气体先通过浓H
2SO
4,再通过灼热的CuO。
(2)除去多种杂质气体的顺序一般是先除去酸性较强的气体。如N2中混有 HCl、H
2O(气)、O
2时,应先除去HCl,再除去水,最后除去O
2(用灼热的铜网)。
(3)检验多种气体的先后顺序(一般先验水蒸气):有多种气体需要检验时,应尽量避免前步检验对后步检验的干扰。如被检验的气体中含有CO
2和水蒸气时,应先通过无水CuSO
4。检验水蒸气,再通过澄清的石灰水检验CO
2.
确定气体收集方法的技巧: (1)排水集气法适用于“不溶于水且小与水反应的气体”,如下图A。
(2)向上排空气法适用于“密度比空气大且小与空气成分反应的气体”(相对分子质量大于29的气体),如下图B。
(3)向下排空气法适用于“密度比空气小且小与空气成分反应的气体”(相对分子质量小于29的气体),如下图C。
(4)不能用排空气法收集的气体
①气体的密度与空气的密度相近时不能用排空气法收集
②当气体与空气中某一成分反应时不能用排空气法收集
(5)有毒气体收集方法的确定
①有毒,但气体难溶于水时,一般采用排水法收集。如下图D
②有毒,但气体叉易溶于水时,则采用带双孔胶塞(一长一短的导气管)的集气瓶利用排空气法收集该气体,但必须接尾气处理装置,以免多余的有毒气体逸散到空气中污染空气,如收集氨气可用图E。
 气体制取实验中关于仪器或装置选择题目的解题技巧:
气体制取实验中关于仪器或装置选择题目的解题技巧: (1)需要研究气体实验室制法的化学反应原理;
(2)需要研究制取这种气体所应采用的实验装置;
(3)需要研究如何证明制得的气体就是要制取的气体。
根据给出的仪器或装置进行选取时,应明确制取气体的发生装置主要是两套(同体加热型和固液常温型),依据反应物的状态和反应条件来确定选用哪套发生装置;气体的收集装置主要就是三套(向上排空气法、向下排空气法和排水法),依据气体的性质来确定选用什么样的收集装置。选择仪器时要注意先对实验原理进行判断,然后再根据原理确定装置所需要的仪器。
实验室制取气体的思路图: