本试题 “下列物质的化学用语正确的是[ ]①NH4H的电子式:②硝基苯的结构简式:③葡萄糖的实验式:CH2O ④甲烷分子的比例模型:⑤Fe2+的离子结构:⑥sp2杂化轨道模型:⑦原子...” 主要考查您对核素
离子结构示意图
电子式的书写
结构简式
实验式(最简式)
比例模型
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 核素
- 离子结构示意图
- 电子式的书写
- 结构简式
- 实验式(最简式)
- 比例模型
定义:
具有一定的质子数和中子数的一种原子叫做核素  的含义:
的含义: 表示一个质量数为A、质子数为Z的原子。
表示一个质量数为A、质子数为Z的原子。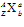 中A表示质量数,Z表示质子数,a表示粒子所带的电荷数和电性,b表示组成该粒子的原子数目。
中A表示质量数,Z表示质子数,a表示粒子所带的电荷数和电性,b表示组成该粒子的原子数目。
元素,核素与同位素的比较:
| 元素 | 同位素 | 核素 | |
| 概念 | 质子数(即核电荷数)相同的一类原子的总称 | 质子数相同而中子数不同的同一元素的不同原子互称为同位素 | 具有一定数目质子和一定数目中子的一种原子 |
| 描述对象 | 宏观物质,列同类原子而言,既有游离态,又有化合态 | 微观物质,对某种元素的原子而言,因为有同位素,所以原子种类多于元素种类 | 微观物质,指某种元素的某种原子 |
| 特征 | 以单质或化合物形式存在,性质通过形成单质或化合物来体现 | 同位素化学性质几乎相同,因为质量数不同,物理性质不同。天然存在的各种同位素所占的原子个数百分比一般不变 | 具有真实的质量,不同核素的质量不相同 |
| 实例 | H、Na、S为不同的三种元素 | 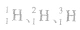 互为同位素 互为同位素 |
 是一种核素, 是一种核素, 是一种核素 是一种核素 |
正离子的离子结构示意图中核内质子数大于核外电子数;
负离子的离子结构示意图中核内质子数小于核外电子数。
原子是否满足最外层8电子结构的判断方法:
1.离子化合物
(1)阳离子:看“主族元素原子的次外层电子数+ 原子的最外层电子数一化合价数”是否等于8,若为8,则该原子满足最外层8电子结构,否则不满足。
(2)阴离子:看“其原子的最外层电子数+化合价的绝对值”是否等于8,若为8,则该原子满足最外层8 电子结构,否则不满足。
2.共价化合物计算“各原子的最外层电子数+化合价的绝对值” 是否等于8,若为8,则该原子满足最外层8电子结构,否则不满足。另外,还有一些不满足8电子结构的特殊粒子,请大家记住:
(1)主族元素形成的化合物中:
a.H、Li、Be、B元素原子不满足最外层8电子结构.
b.非最高价离子(如 Pb2+、Bi3+等)也不满足最外层8电子结构。
(2)过渡金属元素形成的离子最外层电子数一般大于8.
定义:
在化学反应中,一般是原子的最外层电子数目发生变化。为了简便起见,化学中常在元素符号周围用小黑点“· ”或小叉“×”来表示元素原子的最外层电子,相应的式子叫做电子式。
(1)原子的电子式:H· 、Na· 、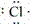
(2)阳离子的电子式:不画出离子最外层电子数,元素右上角标出“n+”电荷字样:Na+、Al3+、Mg2+
(3)阴离子的电子式:要画出最外层电子数,用 “[ ]”括起来,右上角标出“n-”: 、
、 、
、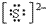
(4)离子化合物的电子式:由阴、阳离子的电子式组成,相同离子不能合并: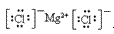 、
、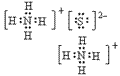
(5)共价化合物的电子式:画出离子最外层电子数: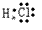 、
、
(6)用电子式表示物质形成的过程:
氯化氢的形成过程: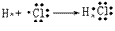
氯化镁的形成过程: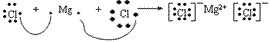
结构式:
共价键中的每一对共用电子用一根短线表示,未成键电子不写出,物质的电子式就变成了结构式。
例如: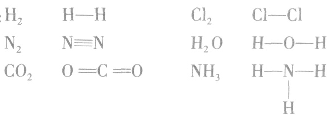
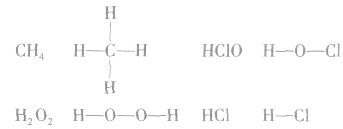
书写电子式的常见错误:
1.漏写未参与成键的电子,如: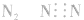
2.化合物类型不清,漏写或多写“[]”及错写电荷数,如: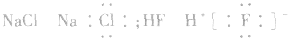
3.书写不规范,错写共用电子对如:N2的电子式为: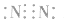 ,不能写成:
,不能写成: ,更不能写成:
,更不能写成: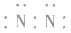 或
或 。
。
4.不考虑原子间的结合顺序如:HClO的电子式为 ,而非
,而非 。因氧原子需形成2对共用电子才能达到稳定结构,而H、 Cl各需形成1对共用电子就能达到稳定结构。
。因氧原子需形成2对共用电子才能达到稳定结构,而H、 Cl各需形成1对共用电子就能达到稳定结构。
5.不考虑原子最外层有几个电子均写成8电子结构如: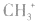 的电子式为
的电子式为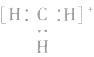 ,而非
,而非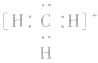 , 因
, 因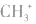 中碳原子最外层应有6个电子(包括共用电子),而非8个电子。
中碳原子最外层应有6个电子(包括共用电子),而非8个电子。
6.不清楚A如型离子化合物中两个B是分开写还是写一块如: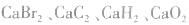 中
中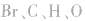 均为-l 价,Br-、H-已达到稳定结构,应分开写;C原子得一个电子,最外层有5个电子,需形成三对共用电子才能达到稳定结构,不能分开写;氧原子得一个电子,最外层有7个电子,需形成一对共用电子才能达到稳定结构,也不能分开写。它们的电子式分别为:
均为-l 价,Br-、H-已达到稳定结构,应分开写;C原子得一个电子,最外层有5个电子,需形成三对共用电子才能达到稳定结构,不能分开写;氧原子得一个电子,最外层有7个电子,需形成一对共用电子才能达到稳定结构,也不能分开写。它们的电子式分别为: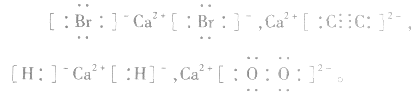
结构式的简便写法,着重突出结构特点(官能团),如CH3-CH3,CH2=CH2
表示物质组成元素原子的最简整数比的式子,如CH3
用不同体积的小球表示不同原子的大小,如:

与“下列物质的化学用语正确的是[ ]①NH4H的电子式:②硝基苯的结构...”考查相似的试题有:
- 下列说法不正确的是[ ]A.O2与O3互为同素异形体 B.丁烷与异丁烷是同分异构体C.SmSm是同一种核素D.H、D、T互为同位素
- 下列说法正确的是( ) A.“钡餐”中使用的硫酸钡是弱电解质 B.Zn具有导电性和还原性,可用作锌锰干电池的负极材料 C.和是中...
- A、B、C、D均为氢化物,其分子中所含原子数依次为2、3、4、4。A、C的分子中原子个数比均为1:1,且电子总数均为18;B与C的元素...
- 下列有关化学用语表达不正确的是[ ]A.氨气分子的电子式:B.S2-的结构示意图:C.CS2分子的结构式:S=C=SD.苯分子的比例...
- 四种短周期元素在周期表中的相对位置如下所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。 请回答下列问题:(1)元素Z...
- X、Y为两种主族元素,原子序数X小于Y,它们与元素Se三种元素原子序数之和为56。已知:X有两种氧化物M和N。Y与Se是相邻周期同...
- 已知某元素A能与ⅦA族某一元素B生成A本身的最高价化合物,在此化合物中B的含量为92.2%,而在A相应的氧化物AO2中,氧的含量为7...
- 下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:(1) 在这些元素中,化学性质最不活泼的是_____(填具体元素符...
- 经测定C3H7OH和C6H12组成的混合物中碳的质量分数为78%,则此混合物中氧的质量分数是( )A.8%B.10%C.22%D.18%
- (6分)新合成的一种烃,其碳架呈正三棱柱体(每条边等长度)(如图所示)(1)写出该烃的分子式 ;(2)该烃的一氯取代物是否...