本试题 “多原子分子的性质与卤素单质相似,故称它们为类卤素化合物,它们可以生成酸和盐,见下表:(表中X代表F、Cl、Br、I)(1)在表中⑴ 、⑵、 ⑶处分别填写相应的化学...” 主要考查您对化学反应方程式
卤素互化物
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 化学反应方程式
- 卤素互化物
化学方程式:
用化学式来表示化学反应的式子,叫做化学方程式。化学方程式不仅表明了反应物、生成物和反应条件,同时,通过相对分子质量或相对原子质量还可以表示个物质之间的质量关系,即各物质之间的质量比。
书写化学方程式要遵守两个原则:
一是必须以客观事实为基础,绝不能凭空臆想、臆造事实上不存在的物质和化学反应;
二是要遵守质量守恒定律,等号两边各原子种类与数目必须相等。
化学方程式的意义:
化学方程式不仅表明了反应物、生成物和反应条件。同时,化学计量数代表了各反应物、生成物物质的量关系,通过相对分子质量或相对原子质量还可以表示各物质之间的质量关系,即各物质之间的质量比。对于气体反应物、生成物,还可以直接通过化学计量数得出体积比。
卤素互化物:
不同卤素原子之间可通过共用电子对形成物质叫卤素互化物。在卤素互化物中,原子半径较大、非金属性较弱的卤素(用X表示)显正价;原子半径较小、非金属性较强的卤素(用Y表示)显负价。由于卤素有+1,+3,+5,+7等多种正价,而负价只有-1价,故卤素互化物通式为(XYnn=1,3,5,7)。如IBr,BrI3,BrF5,IF7等显不同价态的卤素互化物。
类卤化合物:
由两个或两个以上电负性较大的元素的原子组成的原子团,而这些原子团在自由状态时与卤素单质性质相似,故称拟卤素。它们的阴离子则与卤素阴离子性质也相似,故称拟卤离子。目前已经分离出的拟卤素有氰(CN)2、氧氰(OCN)2、硫氰(SCN)和硒氰(SeCN)2。常见的拟卤离子有氰根离子CN-、氰酸根离子OCN-、异氰酸根离子ONC-、硫氰根离子SCN-、硒氰根离子SeCN-、碲氰根离子TeCN-和叠氮酸根离子N3-等。但N3-和TeCN-虽也有卤离子相似的性质,但它没有与单质卤素相应的母体。
拟卤素、拟卤化物与卤素、卤化物的相似性拟卤素、拟卤化物的性质与卤素、卤化物的性质相似的地方很多,主要有以下几点:
(1)游离状态皆有挥发性(聚合体例外)并具有特殊的刺激性气味。
(2)氢化物的水溶液都是氢酸。
(3)形成和卤素形式类似的配离子。如
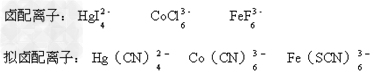
(4)形成多种互化物。如CNCl、CN(SCN)、CN(SeCN)、SCN·Ci以及ClN3、BrN3、IN3等都已制得。
(5)许多化学性质相似。
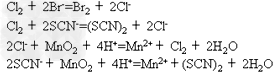
①单质具有氧化性、阴离子具有还原性:
拟卤素单质和卤素单质的氧化性以及拟卤离子和卤素离子的还原性的强弱次序如下:
氧化性:F2>(OCN)2>Cl2>Br2>(CN)2>(SCN)2>I2>(SeCN)2
还原性:F-<OCN-<Cl-<Br-<CN-<SCN-<I-<SeCN-
②单质与碱作用:Cl2+2OH-=ClO-+Cl-+H2O (CN)2+2OH-=OCN-+CN-+H2O
③单质和不饱和烃起加成反应:
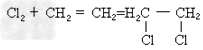
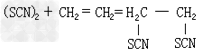
④CN-离子的Ag(Ⅰ)、Hg(Ⅰ)、Pb(Ⅱ)盐和氯、溴、碘的一样,都难溶于水。AgCN和AgCl相似,均可溶于氨水。
发现相似题
与“多原子分子的性质与卤素单质相似,故称它们为类卤素化合物,...”考查相似的试题有:
- 写成下列反应方程式(1)Li与O2反应(点燃)______________________(2)Na与O2反应(点燃)_____________________(3)Na与H...
- 用0.01mol/L NaOH溶液完全中和pH=3的下列溶液各100mL.需NaOH溶液体积最大的是( )A.盐酸B.硫酸C.高氯酸D.醋酸
- 将一定质量的Na2CO3和NaHCO3混合物灼烧至恒重,将放出的气体通入足量的Ca(OH)2饱和溶液中,充分反应后得到的沉淀的质量是1....
- (Ⅰ)一个体重50kg的健康人含铁元素2g,这2g铁元素以Fe2+和Fe3+的形式存在.Fe2+易被吸收,所以给贫血者补充铁时,应补充含Fe...
- 合成氨工业中用铁触媒来催化N2和H2合成NH3.若将a L NH3通过灼热的装有铁触媒的硬质玻璃管后,气体体积变为b L(气体体积均在...
- 能正确表示下列反应的化学方程式是[ ]A. 黄铁矿煅烧:2FeS2+5O22FeO+4SO2B. 石英与石灰石共熔:SiO2+CaOCaSiO3C. 氨的催化...
- 同位素示踪法可用于反应机理的研究,下列有关反应中同位素示踪表示正确的是( )A.2Na218O2+2H2O→4Na18OH+O2↑B.2KMnO4+5H21...
- 四种不含结晶水的固体:①NaHCO3、②NH4HCO3、③Cu(NO3)2、④KNO3,各取1摩在高温下(100℃以上)加热完全分解,得到的气体体积...
- 著名的“侯氏制碱法”第一步反应是向饱和氨化盐水中通入二氧化碳,该反应可表示为NaCl+NH3+CO2+H2O=NaHCO3+NH4Cl有关物质的溶解...
- 酸、碱指示剂本身就是弱酸或弱碱,滴定操作时,酸(碱)首先和被滴定的碱(酸)反应,而后过量酸(碱)和指示剂作用变色,显...