本试题 “(1)甲元素位于元素周期表的第3周期ⅢA族,乙元素的原子结构示意图为①写出甲、乙两种元素符号:甲______、乙______.②甲元素原子核外有______个电子层.③甲元...” 主要考查您对原子核外电子的排布
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 原子核外电子的排布
原子核外电子的排布:
在多电子原子中,由于各电子所具有的能量不同,因而分布在离核远近不同的区域内做高速运动。能量低的电子在离核近的区域内运动,能量高的电子在离核较远的区域内运动。
电子层:
电子层在含有多个电子的原子里,电子分别存能量不同的区域内运动。我们把不同的区域简化为不连续的壳层,也称作电子层,分别用n=1,2,3,4,5.6,7或K、L、 M、N、O、P、Q来表示从内到外的电子层 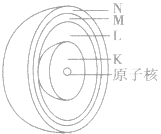

原子结构与元素的性质:
原子的核外电子排布对元素的化学性质有着非常重要的影响。元素的化学性质主要取决于原子的核外最外层电子数。
1.元素的金属性、非金属性(得失电子能力)与最外层电子数的关系
(1)稀有气体元素原子最外层电子数为8(He为 2),已达稳定结构,既不易失电子也小易得电子,所以化学性质不活泼。
(2)金属元素原子最外层电子数一般小于4,较易失去电子而达到稳定结构,其单质表现还原性。
(3)非金属元素原子最外层电子数一般大于或等于4,较易获得电子而达到稳定结构,其单质多表现氧化性。
2.元素的化合价与原子最外层电子数的关系
元素显正价还是显负价及其数值大小与原子的最外层电子数密切相关。其一般规律可归纳如下表: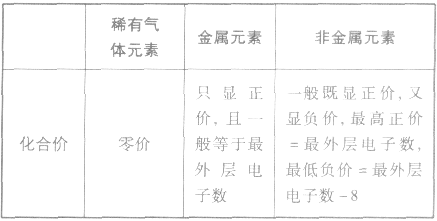
核外电子排布的一般规律:
(1)原子核外各电子层最多容纳2n2个电子.
(2)原子最外层电子数目不超过8个(K层为最外层时不超过2个)。
(3)次外层电子数目不超过18个(K层为次外层时不超过2个,L层为次外层时不超过8个)。倒数第三层电子数目不超过32个。
(4)核外电子分层排布,电子总是优先排布在能量最低的电子层里,然后由里向外,依次排布在能量逐渐升高的电子层里,即最先排K层,当K层排满后,冉排L层等。原子核外电子排布不是孤立的,而是相互联系的。层数相同而位置不同的电子层中最多容纳的电子数小一定相同,如N层为最外层时,最多只能排8个电子;N层为次外层时,最多只能排18个电子而不是32个电子(2×42=32)。
与“(1)甲元素位于元素周期表的第3周期ⅢA族,乙元素的原子结构...”考查相似的试题有:
- 元素x的原子,其M层与K层的电子数相同;元素Y 的原子,其L层上有5个电子。X和Y所形成的稳定化合物的相对分子质量为[ ]A.100B...
- 下列关于粒子结构的描述不正确的是[ ]A.H2S和NH3均是价电子总数为8的极性分子B.HS-和HCl均是含一个极性键的18电子粒子C.CH...
- 五种短周期元素的部分性质数据如下:元素TXYZW原子半径(nm)0.0370.0750.0990.1020.143最高或最低化合价+1+5-3+7-1+6-2+3(1...
- B、C、D、E均是短周期元素,原子序数依次增大,B元素原子最外层上的电子数为内层电子总数的2倍.B元素原子和C元素原子最外层...
- 下列叙述正确的是[ ]A.在多电子的原子里,能量高的电子通常在离核近的区域内活动B.核外电子总是先排在能量低的电子层上C....
- 已知X、Y和Z三种元素的原子序数之和等于42.X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子...
- 有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大,已知A和B原子有相同的电子层数,且A的L层电子数是K层电子数的两...
- 四种短周期元素的性质或结构信息如下表,请根据信息回答下列问题.元素ABCD性质或结构信息单质常温下为固体,难溶于水易于溶C...
- 已知短周期元素的离子:aA2+、bB+、cC3-、dD-都具有相同的电子结构,则下列叙述正确的是[ ]A.原子半径 A>B>D>CB.原子...
- [化学-物质结构与性质]Ⅰ.短周期某主族元素M的电离能如图(A)所示.则M元素位于周期表的第______族.Ⅱ.图B折线c可以表达出...