本试题 “0.05 mol某金属单质与足量的盐酸反应,放出1.12LH2(标准状况),并转变为具有Ar原子的电子层结构的离子,该金属元素在元素周期表中的位置是[ ]A.第三周期第...” 主要考查您对元素周期表
金属、非金属的有关计算
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 元素周期表
- 金属、非金属的有关计算
元素周期表编排原则:
(1)把电子层数相同的各种元素按原子序数递增的顺序从左至右排成横行。
(2)把最外层电子数相同的元素按电子层数递增的顺序由上到下排列成纵行。
注意:①元素周期表是元素周期律的具体表现形式,它反映了元素之间相互联系的规律。
②历史上第一个元素周期表是1869年俄国化学家门捷列夫在前人探索的基础上排成的,他将元素按相对原子质量由小到大依次排列,并将化学性质相似的元素放在一个纵行。
元素周期表的结构:
(1)周期
①周期的含义在元素周期表中,把电子层数相同的元素,按原子序数递增的顺序从左到右排成横行,这样每个横行为一个周期。现在使用的元素周期表有7个横行,即7 个周期。
②周期的划分
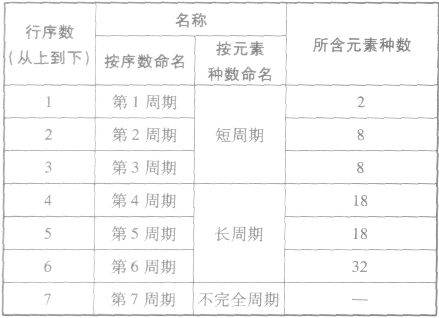
(2)族
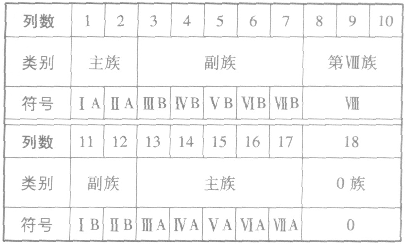
①族的含义在周期表中,把不同横行(即周期)中最外层电子数相同的元素,按电子层数递增的顺序由上到下排成纵行,除第8、9、10三个纵行叫做第Ⅷ族外,其余15个纵行,每个纵行为一族。现在使用的元素周期表有18 个纵行,它们被划分为16个族。
②族的划分
(3)元素周期表中主族元素金属性和非金属性的递变
包括金属及化合物、金属与非金属化合物、非金属化合物之间的反应的计算,解此类题的关键是正确的写出反应方程式,明确物质间的等量关系。明确物质之间的反应,正确写出方程式,此类题可迎刃而解。
AlCl3与NaOH反应的相关计算:
1、求Al(OH)3沉淀的量
2、求反应物碱的量
铝与酸、碱反应的计算规律:
铝分别与盐酸、氢氧化钠溶液反应的原理: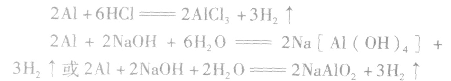
(1)等量铝分别与足量盐酸和氢氧化钠溶液反应,产生氢气的体积比为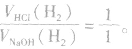
(2)足量的锅分别与等物质的量的盐酸和氢氧化钠溶液反应,产生氢气的体积比为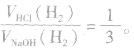
(3)一定量的铝分别和一定量的盐酸和氢氧化钠溶液反应,若产生氢气的体积比为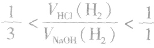 ,则必定是:
,则必定是:
①铝与盐酸反应时,铝过量而盐酸不足;
②铝与氢氧化钠溶液反应时,铝不足而氢氧化钠过量。
解有关硝酸与金属反应的计算题的技巧:
1.灵活运用得失电子守恒、原子守恒及溶液中的电荷守恒关系例如Cu与HNO3反应中就有以下等量关系:
(1)N原子守恒:反应前所有的N只存在于HNO3中;反应后含N的物质有HNO3的还原产物(假设此处有NO3、NO)和Cu(NO3)3,若HNO3过量,则过量HNO3中也含一部分N,则有:n(N)=n(NO2)+ n(NO)+2n[Cu(NO3)3]+n剩(HNO3)。
(2)得失电子守恒:在反应中失去电子的是参加反应的Cu, ;得到电子的是被还原的HNO3(假设还原产物为NO2、NO),NO3-+e→ NO2、NO3-+3e→NO。根据得失电子守恒,则有:
;得到电子的是被还原的HNO3(假设还原产物为NO2、NO),NO3-+e→ NO2、NO3-+3e→NO。根据得失电子守恒,则有: 
(3)溶液中的电荷守恒:在任何溶液中,阴离子所带负电荷总数与阳离子所带正电荷总数在数值上是相等的。在Cu与HNO3反应后的溶液中,若HNO3不过量,阳离子只有Cu2+,阴离子只有NO3-(此类计算不考虑H2O电离出的极少量的H+、OH-);若HNO3过量,溶液中阳离子有Cu2+和H+,阴离子只有NO3-。则有:
①若HNO3不过量: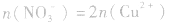
②若HNO3过量: 
2.铁与稀HNO3的反应规律 

(2)上述反应可以认为先发生反应①,若Fe有剩余则发生 ①×2+ ③即得反应②,所以,无论是反应①还是反应②,被还原的HNO3皆占参加反应的HNO3的
①×2+ ③即得反应②,所以,无论是反应①还是反应②,被还原的HNO3皆占参加反应的HNO3的 。
。
有关镁、铝的图像集锦:
Al(OH)3与Al3+、AlO2-之间的转化,是建立在 Al(OH)3两性基础上的,有关相互转化的配比和沉淀Al(OH)3的质量变化,见下表:
与“0.05 mol某金属单质与足量的盐酸反应,放出1.12LH2(标准状况...”考查相似的试题有:
- 下表是元素周期表的一部分,回答下列问题:(1)写出①---⑿号元素的元素符号①___ ②___ ③____ ④____ ⑤____ ⑥____ ⑦___ ⑧____ ⑨_...
- 有原子序数均小于20的A、B、C、D四种元素,已知:① A和B在同一主族,C和D在同一周期;② 四元素相互间可形成A2C、A2C2、B2C2、...
- 某元素X的最高价含氧酸的化学式为HnXO2n-2,则在某气态氢化物中,X元素的化合价为[ ]A.5n-12B.3n-12C.3n-6D.n-10
- 短周期金属元素甲~戊在元素周期表中的相对位置如图所示,下列判断不正确的是( )A.原子半径:丙>丁>戊B.金属性:甲>丙...
- X、Y、Z三种元素的原子,其最外层电子排布分别为ns1、3s23p1和2s22p4,由这三种元素组成的化合物的化学式可能是[ ]A.X3YZ3B...
- 元素X、Y、Z、W均为短周期元素,且原子序数依次增大。已知Y原子最外层电子数占核外电子总数的3/4,W-、Z+、X+半径逐渐减小...
- 下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。试回答下列问题:(1 )请写出元素N 的基态原子电子排布式 ...
- 称取一定质量的纯碱,溶于水中,与适量的盐酸作用,根据下列情况填写盐酸的用量和气体的量的变化.(1)若纯碱中混有K2CO3,盐...
- 2.3g纯净金属钠在干燥空气中被氧化后得到3.5g固体,由此可判断其产物是[ ]A.只有氧化钠B.只有过氧化钠C.氧化钠和过氧化...
- 按下列定量写出硫化氢燃烧的化学方程式。计算各情况下产物(除水外)的物质的量。1molH2S与0.5molO2________________________...