本试题 “一包粗盐中可能含有Na2SO4,Na2CO3杂质中的一种或两种,某同学为了探究清楚粗盐杂质成分进行了以下实验,请帮他完成实验.(1)提出假设:假设1:粗盐中只含...” 主要考查您对测定物质组成、成分含量
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 测定物质组成、成分含量
定量实验介绍:

燃烧法测定氨基酸的组成:
实验室用燃烧法测定某种氨基酸(CxHyOzNp)的分子组成。取Wg该种氨基酸放在纯氧中充分燃烧,生成CO2、H2O和N2。现按下图所示装置进行实验。

①实验开始时,首先要通入一段时间的氧气,目的是排除体系中的N2。
②D装置的作用是吸收未反应的O2,保证最终收集的气体是N2。
③读取N2体积时,应注意:量筒内液面与广口瓶中的液面相持平视线与凹液面最低处相切。
④实验中测得N2的体积为VmL(已折算为标准状况)。为确定此氨基酸的分子式,还需要的有关数据为生成二氧化碳气体的质量、生成水的质量、氨基酸的相对分子质量
用氨气还原氧化铜的方法测定铜的近似相对原子质量:
实验室用氨气还原氧化铜的方法测定铜的近似相对原子质量,反应的化学方程式为:2NH3+3CuO
 N2+3Cu+3H2O
N2+3Cu+3H2O(1)如果选用测定反应物CuO和生成物H2O的质量[m(CuO)、m(H2O)]时,请用下列仪器设计一个简单的实验方案。
装置图:
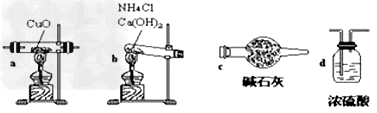
①连接顺序为:bcacd
②d中浓硫酸的作用是吸收未反应的氨、防止空气中水分进入;实验完毕时观察到a中的现象是固体由黑色转变为红色;
③Cu的相对原子质量的表达式
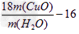
发现相似题
与“一包粗盐中可能含有Na2SO4,Na2CO3杂质中的一种或两种,某同...”考查相似的试题有:
- 用下列实验装置进行的实验能达到实验目的是( ) A.制取Fe(OH)2沉淀 B.制取并收集乙炔 C.制取少量乙酸乙酯 D.测定KClO3...
- 下列说法或表示方法正确的是( ) A.电解稀硫酸不可能发生的反应是Cu+H2SO4CuSO4+H2↑ B.李比希燃烧法、钠熔法、铜丝燃烧法...
- 为确定某铝热剂(含氧化铁和铝)的组成,分别进行下列实验。(1)若取ag样品,向其中加入足量的NaOH溶液,测得生成的气体(标准...
- 有一固体粉末,其中可能含有Na2CO3、NaCl、Na2SO4、CuCl2、Ba(NO3)2、K2CO3、K2SO4中的一种或几种,现按下列步骤进行实验....
- 下列有关化学实验的操作或者说法中,正确的是( )A.用加热法测定胆矾晶体中结晶水含量时,若在空气中冷却会使结果偏低B.配...
- 为测定Na2CO3与Na2SO3混合物中各组分的含量,取样品23.2 g,用下图所示装置进行实验(铁架台、铁夹等仪器未在图中画出)(1)将仪...
- (1)测定Na2O和Na的混合物中金属钠的质量分数可用下图所示的几套仪器组合:①用接口字母标出各仪器连接的顺序______量筒在实...
- 有一包白色固体粉末,其中可能含有KCl、BaCl2、Cu(NO3)2、K2CO3中的一种或几种,现做以下实验:①将部分粉末加入水中,振荡...
- 甲、乙、丙、丁分别是NaOH、AlCl3、BaCl2、MgCl2四种物质中的一种,若将乙溶液滴入丁溶液中,发现有白色沉淀生成,继续滴加则...
- 某铁矿石样品除含SiO2外,还含有FeO、Fe2O3中的一种或两种,某同学对铁的氧化物的成分进行探究.(1)取少量样品于试管A中,...