本试题 “(1)写出实验室制乙烯的化学方程式____________________________________(2)该实验需加入碎瓷片目的是______________________________________(3)下列实...” 主要考查您对气体的检验
乙烯的制取
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 气体的检验
- 乙烯的制取
气体检验的方法:
(1)观察法:对于特殊颜色的气体如Cl2(黄绿色)、NO2(红棕色)、碘蒸气(紫红)可据此辨之。
(2)溶解法:根据溶于水的现象不同区分,如NO2和溴蒸气均为红棕色,但溶于水后NO2形成无色溶液;溴形成橙色溶液。
(3)褪色法:SO2和CO2可用品红溶液区分。
(4)氧化法:被空气氧化看变化,如NO的检验。
(5)试纸法:如石蕊试纸、醋酸铅试纸。
(6)星火发:适用于有助燃性或可燃性的气体检验,如O2使带火星木条复燃;CH4和C2H2的检验可点燃看现象;CH4、CO、H2则可根据其燃烧产物来判断。
常见气体的检验:
(1)H2:无色、无味、可燃;①不纯点燃发出爆鸣声;②点燃纯H2,火焰呈淡色,火焰上方罩一干燥烧杯,烧杯壁上有水珠生成:2H2+O2 2H2O
2H2O
(2)O2:无色无味、能使余烬木条复燃;
(3)Cl2:黄绿色刺激性气体有毒;①使湿润淀粉碘化钾试纸变蓝:Cl2+2KI=2KCl+I2 I2遇淀粉变蓝;②使湿润蓝色石蕊试纸先变红后变白:Cl2+H2O=HCl+HClO HClO强氧化性漂白作用;
(4)CO2:无色无味无毒;①使燃着木条熄灭;②通入澄清石灰水变浑浊:CO2+Ca(OH)2=CaCO3↓+H2O
(5)CO:无色、无味、剧毒;点燃火焰呈蓝色,火焰上方罩一沾有石灰水液滴的烧杯,液滴变浑浊:
2CO+O2 2CO2 CO2+Ca(OH)2=CaCO3↓+H2O
2CO2 CO2+Ca(OH)2=CaCO3↓+H2O
(6)NO2: 红棕色气体有刺激性气味、有毒,溶于水、水溶液呈酸性,能使紫色石蕊试液变红:3NO2+H2O=2HNO3+NO
(7)NO:无色气体有毒;在空气中立即变为红棕色:2NO+O2=2NO2
(8)N2: 无色无味无毒;能使燃着木条熄灭。
(9)SO2:无色有刺激性气味、有毒;①通入品红溶液,品红褪色加热又恢复颜色;②使澄清石灰水变浑浊:
SO2+Ca(OH)2=CaSO3+H2O;
③使酸性高锰酸钾溶液褪色:5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+
(10)HCl:无色刺激性气味;①能使湿润蓝色石蕊试纸变红:HCl=H++Cl-; ②用蘸浓氨水玻璃棒靠近冒白烟:NH3+HCl=NH4Cl;③气体通入HNO3酸化的AgNO3溶液,有白色沉淀生成:HCl+AgNO3=AgCl↓+HNO3 (AgCl不溶于HNO3)
(11)H2S:无色臭鸡蛋气味有毒;遇Pb(NO3)2 、(CH3COO)2Pb、CuSO4溶液均产生黑色沉淀:Pb2++H2S=PbS↓+2H+;2CH3COO-+Pb2++H2S=PbS↓+2CH3COOH;Cu2++H2S=CuS↓+2H+
(12)NH3:无色刺激性气味;①遇湿润红色石蕊试纸变蓝:NH3+H2O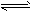 NH3?H2O
NH3?H2O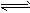 NH4++OH-;②用蘸浓盐酸玻璃棒靠近冒白烟:NH3+HCl==NH4Cl
NH4++OH-;②用蘸浓盐酸玻璃棒靠近冒白烟:NH3+HCl==NH4Cl
(13)CH4:无色无味、可燃;点燃后火焰呈浅蓝色,火焰上方罩一干燥烧杯,烧杯壁上有水珠罩生成;罩一沾有石灰水液滴的烧杯,液滴变浑浊:CH4+2O2 CO2+2H2O CO2+Ca(OH)2==CaCO3↓+H2O
CO2+2H2O CO2+Ca(OH)2==CaCO3↓+H2O
(14)C2H4: 无色稍有气味;①点燃,火焰明亮(少量黑烟):C2H4+3O2 2CO2+2H2O ;②使KMnO4(H+)溶液褪色;③使溴水褪色:CH2=CH2+Br2→CH2Br-CH2Br
2CO2+2H2O ;②使KMnO4(H+)溶液褪色;③使溴水褪色:CH2=CH2+Br2→CH2Br-CH2Br
(15)C2H2:无色无味;①点燃火焰明亮并伴有大量黑烟:2C2H2+5O2 4CO2+2H2O;②使KMnO4(H+)溶液褪色;③使溴水褪色:CH≡CH+2Br2→CHBr2-CHBr2
4CO2+2H2O;②使KMnO4(H+)溶液褪色;③使溴水褪色:CH≡CH+2Br2→CHBr2-CHBr2
(1)观察法:对于特殊颜色的气体如Cl2(黄绿色)、NO2(红棕色)、碘蒸气(紫红)可据此辨之。
(2)溶解法:根据溶于水的现象不同区分,如NO2和溴蒸气均为红棕色,但溶于水后NO2形成无色溶液;溴形成橙色溶液。
(3)褪色法:SO2和CO2可用品红溶液区分。
(4)氧化法:被空气氧化看变化,如NO的检验。
(5)试纸法:如石蕊试纸、醋酸铅试纸。
(6)星火发:适用于有助燃性或可燃性的气体检验,如O2使带火星木条复燃;CH4和C2H2的检验可点燃看现象;CH4、CO、H2则可根据其燃烧产物来判断。
常见气体的检验:
(1)H2:无色、无味、可燃;①不纯点燃发出爆鸣声;②点燃纯H2,火焰呈淡色,火焰上方罩一干燥烧杯,烧杯壁上有水珠生成:2H2+O2
 2H2O
2H2O (2)O2:无色无味、能使余烬木条复燃;
(3)Cl2:黄绿色刺激性气体有毒;①使湿润淀粉碘化钾试纸变蓝:Cl2+2KI=2KCl+I2 I2遇淀粉变蓝;②使湿润蓝色石蕊试纸先变红后变白:Cl2+H2O=HCl+HClO HClO强氧化性漂白作用;
(4)CO2:无色无味无毒;①使燃着木条熄灭;②通入澄清石灰水变浑浊:CO2+Ca(OH)2=CaCO3↓+H2O
(5)CO:无色、无味、剧毒;点燃火焰呈蓝色,火焰上方罩一沾有石灰水液滴的烧杯,液滴变浑浊:
2CO+O2
 2CO2 CO2+Ca(OH)2=CaCO3↓+H2O
2CO2 CO2+Ca(OH)2=CaCO3↓+H2O (6)NO2: 红棕色气体有刺激性气味、有毒,溶于水、水溶液呈酸性,能使紫色石蕊试液变红:3NO2+H2O=2HNO3+NO
(7)NO:无色气体有毒;在空气中立即变为红棕色:2NO+O2=2NO2
(8)N2: 无色无味无毒;能使燃着木条熄灭。
(9)SO2:无色有刺激性气味、有毒;①通入品红溶液,品红褪色加热又恢复颜色;②使澄清石灰水变浑浊:
SO2+Ca(OH)2=CaSO3+H2O;
③使酸性高锰酸钾溶液褪色:5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+
(10)HCl:无色刺激性气味;①能使湿润蓝色石蕊试纸变红:HCl=H++Cl-; ②用蘸浓氨水玻璃棒靠近冒白烟:NH3+HCl=NH4Cl;③气体通入HNO3酸化的AgNO3溶液,有白色沉淀生成:HCl+AgNO3=AgCl↓+HNO3 (AgCl不溶于HNO3)
(11)H2S:无色臭鸡蛋气味有毒;遇Pb(NO3)2 、(CH3COO)2Pb、CuSO4溶液均产生黑色沉淀:Pb2++H2S=PbS↓+2H+;2CH3COO-+Pb2++H2S=PbS↓+2CH3COOH;Cu2++H2S=CuS↓+2H+
(12)NH3:无色刺激性气味;①遇湿润红色石蕊试纸变蓝:NH3+H2O
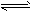 NH3?H2O
NH3?H2O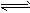 NH4++OH-;②用蘸浓盐酸玻璃棒靠近冒白烟:NH3+HCl==NH4Cl
NH4++OH-;②用蘸浓盐酸玻璃棒靠近冒白烟:NH3+HCl==NH4Cl (13)CH4:无色无味、可燃;点燃后火焰呈浅蓝色,火焰上方罩一干燥烧杯,烧杯壁上有水珠罩生成;罩一沾有石灰水液滴的烧杯,液滴变浑浊:CH4+2O2
 CO2+2H2O CO2+Ca(OH)2==CaCO3↓+H2O
CO2+2H2O CO2+Ca(OH)2==CaCO3↓+H2O (14)C2H4: 无色稍有气味;①点燃,火焰明亮(少量黑烟):C2H4+3O2
 2CO2+2H2O ;②使KMnO4(H+)溶液褪色;③使溴水褪色:CH2=CH2+Br2→CH2Br-CH2Br
2CO2+2H2O ;②使KMnO4(H+)溶液褪色;③使溴水褪色:CH2=CH2+Br2→CH2Br-CH2Br (15)C2H2:无色无味;①点燃火焰明亮并伴有大量黑烟:2C2H2+5O2
 4CO2+2H2O;②使KMnO4(H+)溶液褪色;③使溴水褪色:CH≡CH+2Br2→CHBr2-CHBr2
4CO2+2H2O;②使KMnO4(H+)溶液褪色;③使溴水褪色:CH≡CH+2Br2→CHBr2-CHBr2 物质检验的基本原则:
物质检验的“三个原则”,即一看(颜色、状态)、二嗅(气味)、三实验(加试剂)。根据实验时生成物所表现的现象不同,检验离子的方法可归纳为四类:
(1)生成气体,如 的检验;
的检验;
(2)生成沉淀,如 的检验;
的检验;
(3)显现特殊颜色,如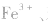 苯酚的检验。
苯酚的检验。
(4)焰色反应:检验金属或金属离子。
乙烯的制取:
(1)实验室里是把酒精和浓硫酸按1:3混合迅速加热到170℃,使酒精分解制得。浓硫酸在反应过程里起催化剂和脱水剂的作用。
制取乙烯的反应属于液--液加热型
C2H6O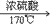 CH2=CH2↑+H2O
CH2=CH2↑+H2O
(2)装置图: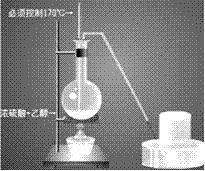
(3) 注意事项:
①酒精和浓硫酸按体积1比3混和,使乙醇利用率提高,必须使用无水酒精,而且必须控制170摄氏度才能制得乙烯。装置连接时由下至上,由左至右。温度计插入液面下。
②烧瓶内加沸石以避免暴沸。
③温度计水银头插入液面下,但不要接触烧瓶底部,以测定液体温度。
④要使液面温度迅速升到170摄氏度,以避免副反应发生。
(4)收集方法:乙烯的密度与空气相当,所以不能用排空气取气法,只能用排水法收集。
检验:点燃时火焰明亮,冒黑烟,产物为水和CO2;通入酸性高锰酸钾溶液中,紫色高锰酸钾褪色。
(5)实验现象:生成无色气体,烧瓶内液体颜色逐渐加深。
(6)两点说明
①实验室中用无水乙醇和浓硫酸制取乙烯气体,加热不久圆底烧瓶内的液体容易变黑,原因是:浓硫酸将无水乙醇氧化生成碳单质等多种物质,碳单质使烧瓶内的液体带上了黑色。制得的C2H4中往往混有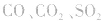 等气体。
等气体。
②实验时要求使反应温度迅速卜升到170℃并稳定在170℃左右,因该温度下主要产物是乙烯和水,而在140℃时主要产物是乙醚和水,当温度高于170℃ 时,乙醇和浓硫酸发生的氧化反应更加突出,反应产物有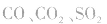 等多种物质。相关反应方程式为:
等多种物质。相关反应方程式为: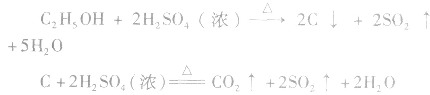
发现相似题
与“(1)写出实验室制乙烯的化学方程式________________________...”考查相似的试题有:
- 下图是模拟氯碱工业生产中检查氯气是否泄漏的装置,下列有关说法错误的是[ ]A.烧瓶中立即出现白烟B.烧瓶中立即出现红棕色C...
- 下列实验设计和结论不相符的是[ ]A.某无色无味气体通入澄清石灰水中,石灰水变浑浊,则该气体为CO2B.某气体能使湿润的红色...
- 下列操作不能用于检验NH3的是[ ]A.气体使湿润的酚酞试液变红B.气体能使湿润的红色石蕊试纸变蓝C.气体与蘸有浓H2SO4的玻璃...
- 下图虚线框中的装置可用来检验浓硫酸与木炭粉在加热条件下反应产生的所有气体产物,填写下列空白。⑴如果将仪器①②③连接 顺序改...
- 以下物质的实验室制备不合理的是A.用铅皿制备HFB.用浓硫酸制备HIC.用磨砂接口的装置制备HNO3D.用饱和食盐水代替水制备乙炔
- 实验室用下图所示装置通过制取NH3再和CuO 反应制得N2,同时还原CuO 得Cu 。(1)写出(A)中反应的化学方程式_______ __;(2...
- (12分)某校化学小组学生利用下图所示装置进行“乙二酸晶体受热分解”的实验,并验证分解产物中有CO2和CO。(图中夹持装置及尾...
- 下图中a、b、c表示相应仪器中加入的试剂,可用下图装置制取、净化、收集的气体是编号气体abcANH3浓氨水生石灰碱石灰BCO2盐酸...
- 下面是实验室可制取氨气的装置和选用的试剂,其中正确的是( )A.①③④B.只有③C.①②D.①②④
- 实验题(10分)⑴实验室配制500 mL 0.1mol/L的氢氧化钠,请回答下列问题:①称量氢氧化钠固体时应放在 中进行:②配制溶液时应选...