本试题 “I、卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物.(1)①HClO4、②HIO4、③H5IO6的酸性由强到弱的顺序为______(填序号).(2)...” 主要考查您对无机分子的立体结构
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 无机分子的立体结构
分子中原子的空间关系是分子表现出不同的空间构型。
用价层电子对互斥理论确定分子或离子的VSEPR模型和立体构型的方法:
首先计算分子或离子中的中心原子的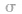 键电子对数和孤电子对数,相加便得到中心原子的价层电子对数。然后由价层电子对的相互排斥,便得到含有孤电子对的VSEPR模型,再略去VSEPR模型中的中心原子的孤电子对,便可得到分子的立体构型。
键电子对数和孤电子对数,相加便得到中心原子的价层电子对数。然后由价层电子对的相互排斥,便得到含有孤电子对的VSEPR模型,再略去VSEPR模型中的中心原子的孤电子对,便可得到分子的立体构型。
1.价层电子对数的确定方法
(1) 键电子对数:由分子式确定,中心原子形成的
键电子对数:由分子式确定,中心原子形成的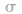 键的数目就是
键的数目就是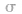 键电子对数。如
键电子对数。如 分子中的中心原子
分子中的中心原子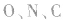 分别有2、3、4对
分别有2、3、4对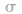 键电子对。
键电子对。
(2)孤电子对数
①分子中的中心原子上的孤电子对数
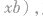 式中a为中心原子的价电子数(主族元素原子的价电子就是最外层电子);x为与中心原子结合的原子数;b为与中心原子结合的原子最多能接受的电子数 (氢为l,其他原子等于“8一该原子的价电子数”)。
式中a为中心原子的价电子数(主族元素原子的价电子就是最外层电子);x为与中心原子结合的原子数;b为与中心原子结合的原子最多能接受的电子数 (氢为l,其他原子等于“8一该原子的价电子数”)。
以 为例,a均为6,x分别为2和3,b均为2(氧原子最多能接受的电子数为2),则
为例,a均为6,x分别为2和3,b均为2(氧原子最多能接受的电子数为2),则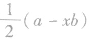 分别为1和0,即SO2的中心原子上的孤电子对数为l, SO3的中心原子上没有孤电子对。
分别为1和0,即SO2的中心原子上的孤电子对数为l, SO3的中心原子上没有孤电子对。
②对于阳离子,a为中心原子的价电子数减去离子的电荷数;对于阴离子,a为中心原子的价电子数加上离子的电荷数(绝对值)。x和b的计算方法及计算公式[中心原子上的孤电子对数= ]均不变。
]均不变。
2.确定分子(或离子)的VSEPR模型
根据价层电子对数和价层电子对的相互排斥,可得出分子或离子的VSEPR模型,其关系如下表。 
3.确定分子(或离子)的立体构型略去VSEPR模型中的中心原子上的孤电子对,便可得到分子或离子的立体构型,如上表。
(1)分子或离子中的价层电子对数分别为2、3、4,则其VSEPR模型分别为直线形、平面三角形、正四面体形或四面体形。如果价层电子对数为5,则为三角双锥形;如果为6,则为正八面体形或八面体形。
(2)如果中心原子的孤电子对数为0,则VSEPR模型(及名称)和分子或离子的立体构型(及名称)是一致的;若孤电子对数不为0,则二者不一致。
与“I、卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等...”考查相似的试题有:
- 下列各组互为等电子体的是A.N2O和CO2B.O3和NO2C.CH4和NH3D.OH-和NH2-
- 意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的气态N4分子,其分子结构如右图所示。已知断裂1 mol N—N吸收167 k...
- PtCl2(NH3)2可以形成两种固体,一种为淡黄色,在水中的溶解度小,另一种为黄绿色,在水中的溶解度较大,请回答下列问题:(1...
- 下列叙述正确的是( )A.P4和NO2都是共价化合物B.CCl4和NH3都是以极性键结合的极性分子C.在CaO和SiO2晶体中,都不存在单个...
- 下列说法正确的是 A.构成单质分子的微粒一定含有共价键B.熔融时能导电的化合物,一定是离子化合物C.水加热至1000℃也不分解...
- 下图中,表示氧原子,表示氢原子。根据此图,请从宏观、微观两个方面写出获得的化学信息。(可不填满,也可补充)(1)______...
- 下图是已经合成的最著名硫-氮化合物分子结构。下列说法正确是( )A.该物质的分子式为SNB.该物质的分子中既有极性键又有非...
- 右图为冰的一种骨架形式,依此为单位向空间延伸,则x mol冰中含有多少mol氢键:A.2xB.4xC.6xD.8x
- 下列各组物质中,都是由极性键构成的极性分子的一组是 ( )A.NH3和H2OB.CH4和Br2C.H2S和CCl4D.CO2和HCl
- 下列叙述中的距离属于键长的是( )A.氨分子中两个氢原子间的距离B.氯分子中两个氯原子间的距离C.金刚石晶体中任意两个相邻...