本试题 “某种含有少量FeCl2杂质的FeCl3样品,现要测定其中铁元素的含量.实验采用以下步骤进行:1.准确称量m g样品(2~3g);2.向样品中加入10mL 5mol/L的盐酸,再...” 主要考查您对铁盐(三价铁离子)
亚铁盐(二价铁离子)
测定物质组成、成分含量
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 铁盐(三价铁离子)
- 亚铁盐(二价铁离子)
- 测定物质组成、成分含量
Fe3+的性质:
含Fe3+的溶液都呈黄色,具有氧化性,
(1)与还原剂反应生成二价铁 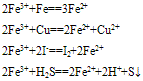
(2)与碱反应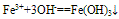
(3)Fe3+在水中易水解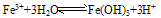
由于三价铁易水解,在保存铁盐盐溶液(FeCl3)时加入少量相应的酸(HCl),以防止Fe3+水解。
“铁三角”中的转化关系:
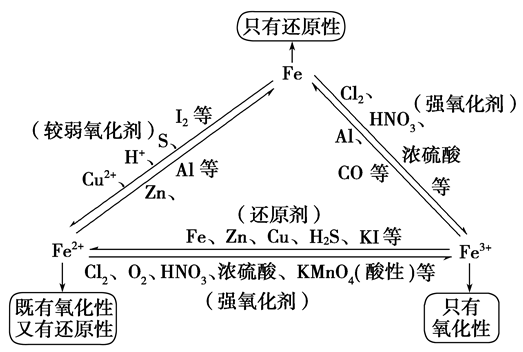
浅绿色溶液,既有氧化性性又具有还原性,主要表现还原性
(1)与氧化剂反应生成三价铁 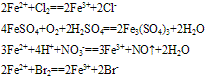
(2)与碱反应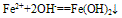
(3)Fe2+易被氧化,水溶液中易水解。亚铁盐溶液(FeCl2)在保存时加入少量铁屑以防止Fe2+被氧化,滴入少量相应的酸溶液(HCl),防止Fe2+水解。
定量实验介绍:

燃烧法测定氨基酸的组成:
实验室用燃烧法测定某种氨基酸(CxHyOzNp)的分子组成。取Wg该种氨基酸放在纯氧中充分燃烧,生成CO2、H2O和N2。现按下图所示装置进行实验。

①实验开始时,首先要通入一段时间的氧气,目的是排除体系中的N2。
②D装置的作用是吸收未反应的O2,保证最终收集的气体是N2。
③读取N2体积时,应注意:量筒内液面与广口瓶中的液面相持平视线与凹液面最低处相切。
④实验中测得N2的体积为VmL(已折算为标准状况)。为确定此氨基酸的分子式,还需要的有关数据为生成二氧化碳气体的质量、生成水的质量、氨基酸的相对分子质量
用氨气还原氧化铜的方法测定铜的近似相对原子质量:
实验室用氨气还原氧化铜的方法测定铜的近似相对原子质量,反应的化学方程式为:2NH3+3CuO
 N2+3Cu+3H2O
N2+3Cu+3H2O(1)如果选用测定反应物CuO和生成物H2O的质量[m(CuO)、m(H2O)]时,请用下列仪器设计一个简单的实验方案。
装置图:
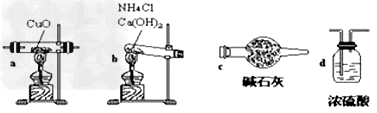
①连接顺序为:bcacd
②d中浓硫酸的作用是吸收未反应的氨、防止空气中水分进入;实验完毕时观察到a中的现象是固体由黑色转变为红色;
③Cu的相对原子质量的表达式
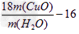
发现相似题
与“某种含有少量FeCl2杂质的FeCl3样品,现要测定其中铁元素的含...”考查相似的试题有:
- 在FeCl3溶液中,加入过量的铜粉,充分反应后,溶液中存在的金属离子是( ) A.Fe2+和Cu2+ B.Fe3+ C.Cu2+ D.Fe2+
- 把SO2通入Fe(NO3)3溶液中,溶液由黄色变为浅绿色,但立即又变为黄色,此时若滴入BaCl2溶液,则会产生白色沉淀。在上述一系列...
- 下列关于Fe2+和Fe3+的叙述中,错误的是( ) A.Fe2+的水溶液为浅绿色 B.Fe2+既有氧化性,又有还原性 C.Fe3+的水溶液为黄色...
- 把铁粉放入CuCl2和FeCl3的混合溶液中充分反应,下列说法中正确的是( ) A.若无铜析出,则溶液中一定有Cu2+、Fe2+和Fe3+ B....
- 以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下回答下列问题:(1)在一定条件下,SO2转化为S...
- I.(了)对下列仪器:A.移液管 B.蒸馏烧瓶 C.滴定管 D.量筒E.容量瓶 F.蒸发皿 G.分液漏斗 E.吸滤瓶①使用时必须检查...
- 补铁剂中铁元素的含量是质检部门衡量其质量的重要指标,实验主要包括如下步骤:①配制0.01mol•L-1、0.008mol•L-1等一系列浓度...
- Ⅰ高纯MnCO3是制备高性能磁性材料的主要原料.实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下:(1)制备MnSO4溶液:在烧...
- 某种含有少量氧化钠的过氧化钠试样(已知试样质量为1.560g、锥形瓶和水的质量 190.720g),利用左图装置测定混合物中Na2O2...
- 室内甲醛污染已被列入对公众健康影响最大的环境因素之一,市面上有一种光催化涂料,能够起到降低室内甲醛含量的作用.某化学...