本试题 “下列叙述正确的是[ ]A.NaCl溶液在电流作用下电离成Na+和Cl-B.NaCl是电解质故NaCl晶体能导电C.氯化氢溶于水能导电,但液态氯化氢不能导电D.导电性强的溶液...” 主要考查您对导电性(单质、溶液、熔融状态导电)
强电解质电离(氯化钠、硫酸氢钠等物质的电离)
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 导电性(单质、溶液、熔融状态导电)
- 强电解质电离(氯化钠、硫酸氢钠等物质的电离)
电解质溶液的导电性和导电能力:
1.金属靠自由电子的定向移动而导电,属于物理现象,温度升高时电阻增大,导电能力减弱。电解质溶液靠自由离子的定向移动而导电。电解质溶液(或熔融电解质)在导电的同时要发生化学变化,即被电解。
2.影响电解质溶液导电能力的因素
(1)自由移动离子浓度的大小(主要决定因素):温度一定,离子浓度越大,导电能力越强。
(2)温度:温度越高,导电能力越强(与金属导电相反)。
(3)单个离子所带电荷数:电荷数越高,导电能力越强。例如:氨水中通入少量HCl,原来的氨水是弱电解质溶液,离子浓度较小,导电能力较弱,当通入少量HCl 转变成NH4Cl时,因NH4Cl完全电离,离子浓度明显增大,故导电能力增强。
3.强电解质溶液的导电能力不一定比弱电解质溶液的强。例如:较浓醋酸的导电能力比极稀HCl溶液强,这是由溶液中自南移动离子浓度大小决定的。又如:CaCO3虽为强电解质,但溶于水所得溶液极稀,自由移动离子的浓度太小,溶液导电能力极差。
1.金属靠自由电子的定向移动而导电,属于物理现象,温度升高时电阻增大,导电能力减弱。电解质溶液靠自由离子的定向移动而导电。电解质溶液(或熔融电解质)在导电的同时要发生化学变化,即被电解。
2.影响电解质溶液导电能力的因素
(1)自由移动离子浓度的大小(主要决定因素):温度一定,离子浓度越大,导电能力越强。
(2)温度:温度越高,导电能力越强(与金属导电相反)。
(3)单个离子所带电荷数:电荷数越高,导电能力越强。例如:氨水中通入少量HCl,原来的氨水是弱电解质溶液,离子浓度较小,导电能力较弱,当通入少量HCl 转变成NH4Cl时,因NH4Cl完全电离,离子浓度明显增大,故导电能力增强。
3.强电解质溶液的导电能力不一定比弱电解质溶液的强。例如:较浓醋酸的导电能力比极稀HCl溶液强,这是由溶液中自南移动离子浓度大小决定的。又如:CaCO3虽为强电解质,但溶于水所得溶液极稀,自由移动离子的浓度太小,溶液导电能力极差。
强电解质电离:
强电解质在溶液中完全电离,且符号为“=”,如NaCl=Na++Cl-、NaHSO4==Na++H++SO42-
强电解质在溶液中完全电离,且符号为“=”,如NaCl=Na++Cl-、NaHSO4==Na++H++SO42-
酸与碱反应的几种情况:
1.等体积、等物质的量浓度的酸 混合
混合 
2.等体积的酸 混合
混合 
3.若酸 等体积混合溶液呈中性
等体积混合溶液呈中性 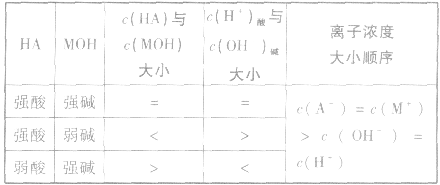
4.强酸溶液(pH=a)与强碱溶液(pH=b)完全中和时的体积比

发现相似题
与“下列叙述正确的是[ ]A.NaCl溶液在电流作用下电离成Na+和Cl-B...”考查相似的试题有:
- 下列物质中,导电性能最差的是[ ]A.熔融氢氧化钠B.石墨棒C.盐酸溶液D.固态氯化钠
- 有以下几种物质①碳酸氢钠晶体②液态氯化氢③铁④蔗糖⑤酒精⑥熔融的K2SO4⑦干冰⑧石墨填空回答:(填序号)(1)以上物质能导电的是_...
- 下列说法正确的是( )A.在101 kPa、25℃时,中和热为57.3 kJ/mol,则表示Ba(OH)2的稀溶液与足量稀硫酸反应的热化学方程式...
- 氯化钠是一种重要的生活、生产必需品.下列叙述中正确的是( )A.锌粒与盐酸反应时,若加入适量氯化钠晶体,可加快反应速率B...
- 向一定量的Ba(OH)2溶液中逐滴加入稀硫酸直至过量.图中可近似表示整个过程中混合溶液的导电能力(用电流强度I表示)的曲线...
- 物质的量浓度相同,体积相同的下列溶液中,所含溶质的离子数目最多的是( )A.NaCl溶液B.AlCl3溶液C.Na2SO4溶液D.Al2(SO...
- 在0.1mol下列物质置于1L水中,充分搅拌后,溶液中阴离子数最多的是[ ]A.KBrB.Mg(OH)2C.Na2CO3D.MgSO4
- 把0.05mol醋酸分别加入到下列100mL溶液中,溶液的导电能力变化最明显的( )A.0.5mol/LNaOH溶液B.0.5mol/L盐酸C.0.5mol/LN...
- 已知0.5L盐酸和硫酸的混合溶液中含有0.1mol Cl-和0.2mol SO42-,则此溶液中H+的物质的量浓度是( )A.1 mol/LB.0.5 mol/LC...
- 浓度均为0.1mol/L的8种溶液① HNO3② H2SO4③ CH3COOH ④ Ba(OH)2⑤ NaOH ⑥ CH3COONa⑦ KCl ⑧ NH4Cl,溶液PH由大到小的顺序是_____...