本试题 “(改编)下列说法正确的是( )A.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率B.电解MgCl2饱和溶液,可制得金属镁C.用苯萃取溴水中的溴,分液时有机层从分...” 主要考查您对电冶金
金属的电化学腐蚀
金属的化学腐蚀
金属的电化学防护
金属的表面防护
萃取
分液
酸碱中和滴定
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 电冶金
- 金属的电化学腐蚀
- 金属的化学腐蚀
- 金属的电化学防护
- 金属的表面防护
- 萃取
- 分液
- 酸碱中和滴定
电冶金:
(1)电解法:用电解的手段将活泼金属(如Na、Ca、 Mg、Al)从它们的化合物中还原出来的方法。
(2)实例
a.电解熔融NaCl制Na
b.电解熔融Al2O3制Al
金属的腐蚀:
1.金属腐蚀的概念金属与周围的气体或液体物质发生氧化还原反应而引起损耗的现象。
2.金属腐蚀的实质金属原子(M)失去电子而被氧化的过程。
M-ne-==M n+
金属的电化学腐蚀:
不纯的金属或合金因发生原电池反应而造成的腐蚀。最普遍的钢铁腐蚀是:
负极:2Fe-4e-=2Fe2+
正极:O2+2H2O+4e-=4OH- (注:在少数情况下,若周围介质的酸性较强,正极的反应是:2H++2e-=H2↑)
金属的腐蚀以电化腐蚀为主.例如,钢铁生锈的主要过程为
(1)吸氧腐蚀:金属在酸性很弱或中性溶液里,空气里的氧气溶解于金属表面水膜中而发生的电化腐蚀。
①发生条件:水膜的酸性很弱或呈中性
②反应本质:形成原电池
③铁为负极,(氧化反应);正极反应:(还原反应)
(2)析氢腐蚀:在酸性较强的溶液中发生电化腐蚀时放出氢气,这种腐蚀叫做析氢腐蚀。
①发生条件:水膜的酸性较强
②反应本质:形成原电池
③铁为负极,(氧化反应);正极反应:(还原反应)
钢铁的电化学腐蚀的两种类型:


金属腐蚀快慢的判断:
金属腐蚀的快慢与下列两个因素有关:
(1)与构成原电池的材料有关,两极材料的活泼性差别越大,电动势越大,氧化还原反应的速率越快,活泼金属被腐蚀的速率就越快。
(2)与金属所接触的电解质溶液的性质有关,活泼金属在电解质溶液中的腐蚀快于在非电解质溶液中的腐蚀,在强电解质溶液中的腐蚀快于在弱电解质溶液中的腐蚀。一般来说,可用下列原则判断:电解原理引起的腐蚀>原电池原理引起的腐蚀> 化学腐蚀>有防护措施的腐蚀
金属的化学腐蚀:
1、定义:金属跟接触到的干燥气体(如O2、Cl2、SO2 等)或非电解质液体 (如石油)等直接发生化学反应而引起的腐蚀
2、条件:金属跟氧化剂直接接触
3、现象:无电流产生
4、本质:金属被氧化而腐蚀
5、反应速率:v(电化学腐蚀)>v(化学腐蚀)
(1)外加电流的阴极保护法。如把金属连接在电源的负极上,这样就能消除引起金属腐蚀的原电池反应。
(2)牺牲阳极的阴极保护法。如在金属上铆接比它更活泼的另一种金属,发生金属腐蚀时是较活泼的金属被腐蚀而金属本身受到保护。
金属的表面防护:
(1)改变金属的组成或结构。如在铁中加入一定比例的铬炼制的铬钢,具有很强的耐腐蚀性。既含铬又含镍的铬镍不锈钢,其耐腐蚀性更好。
(2)在金属表面覆盖一层保护膜,使金属与周围具有腐蚀性的气体或电解质溶液隔离,便可保护金属,防止金属腐蚀。如在金属表面喷漆、电镀或表面钝化等。
| 名称 | 用途 | 装置 | 举例 | 注意事项 |
| 萃取 | 分离两种互溶的液体 |  |
CCl4把溴水中的Br2萃取出来 |
①萃取后再进行分液操作 ②对萃取剂的要求:与原溶剂互不混溶,不反应;溶质在其中的溶解度比在原溶剂中大;溶质不与萃取剂反应 ③萃取后得到的仍是溶液,一般要通过分馏等方法进一步分离 |
分液:
| 名称 | 用途 | 装置 | 举例 | 注意事项 |
| 分液 | 分离两种不相混溶的液体(密度不同) | 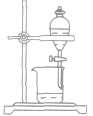 |
水、苯的分离 | 下层液体从下口放出,上层液体从上口倒出 |
酸碱中和滴定:
用已知物质的量浓度的酸(或碱)来测 定未知物质的量浓度的碱(或酸)的方法叫做酸碱中和滴定。
(1)原理:对于一元酸和一元碱发生的中和反应,C酸V酸=C碱V碱 或:C未知V未知=C标准V标准,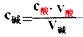
(2)仪器:a.酸式滴定管 b.碱式滴定管c.铁架台d.滴定管夹e.锥形瓶 f.烧杯g.胶头滴管等
(3)装置图: 
(4)操作步骤:
洗涤、检漏、水洗、润洗、装液、去泡、调液面记录、放待测液、加指示剂、滴定、记录、
计算、误差分析
(5)数据处理依据:
c(NaOH)=c(HCl)V(HCl)/V(NaOH)
(6)误差分析:
①仪器润洗不当:
a.盛标准液的滴定管用蒸馏水洗后未用标准液润洗;
b.盛待测液滴定(移液)管用蒸馏水洗后未用待测液润洗;
c.锥形瓶用蒸馏水洗后再用待测液润洗;
②读数方法有误:
a.滴定前仰视,滴定后俯视;
b.滴定前俯视,滴定后仰视;
c.天平或量筒的使用读数方法错误;
③操作出现问题:
a.盛标准液的滴定管漏液;
b.盛待测液的滴定管滴前尖嘴部分有气泡,终了无气泡
(或前无后有);
c.振荡锥形瓶时,不小心有待测液溅出;
d.滴定过程中,将标准液滴到锥形瓶外;
中和滴定中的误差分析:
中和滴定是一个要求较高的定量实验,每一个不当的或错误的操作都会引起误差。
对于一元酸与一元碱,由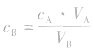 可知,
可知,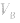 是准 确量取的体积,
是准 确量取的体积, 是标准溶液的浓度,它们均为定值,所以
是标准溶液的浓度,它们均为定值,所以 的大小取决于
的大小取决于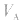 的大小,
的大小,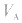 大则
大则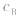 大,
大,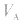 小则
小则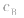 小。
小。
以标准酸溶液滴定末知浓度的碱溶液(酚酞作指示剂)为例,常见的不正确操作对实验结果的影响见下表: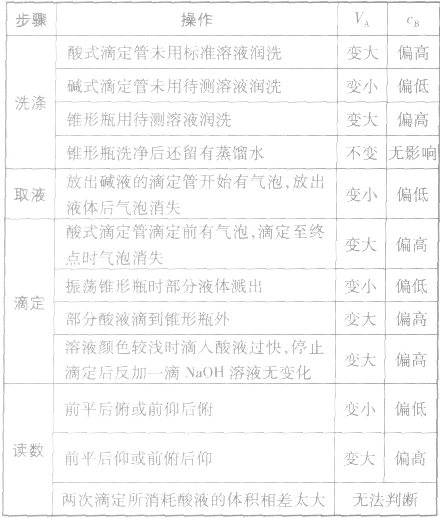
中和滴定应注意的问题:
1.中和滴定中指示剂的使用与选择
(1)用量不能太多,常用2~3滴,冈指示剂本身也是有机弱酸或有机弱碱,若用量太多,会使中和滴定中需要的酸或碱的量增多或减少。
(2)指示剂的选择:中和滴定时一般选用的指示剂有酚酞和甲基橙。石蕊试液由于颜色变化不明显,不易辨别,在滴定过程中不宜使用。
(3)酸、碱恰好完全反应时,终点溶液的pH应在指示剂的变色范围内,如强酸溶液滴定弱碱溶液应选用甲基橙作指示剂;强碱溶液滴定弱酸溶液应选用酚酞作指示剂。
(4)指示剂的变色:最好由浅到深,这样对比明显。如用强碱滴定强酸用酚酞作指示剂较好,当酚酞从无色变为粉红色(或浅红色)且半分钟内不褪色时即达到滴定终点。
2.欲减小实验误差的三点做法
(1)半分钟:振荡,半分钟内颜色不褪去,即为滴定终点。
(2)l一2min:滴定停止后,必须等待l~2min,让附着在滴定管内壁的溶液流下后,再进行读数。
(3)重复:同一实验,要做两到三次,两次滴定所用标准溶液的体积的差值不能超过0.02mL,再取平均值。
与“(改编)下列说法正确的是( )A.在海轮外壳上镶入锌块,可...”考查相似的试题有:
- Ⅰ.钢铁工业是国家工业的基础.请回答钢铁腐蚀、防护过程中的有关问题.请写出钢铁在碱性、潮湿的环境下发生电化学腐蚀正极的...
- 下列事实中,与电化学腐蚀无关的是A.轮船水线以下的船壳上镶嵌有一定量的锌块B.镀锌的铁制品比镀锡的铁制品耐用C.埋在潮湿...
- 下列叙述的方法不正确的是( )A.金属的电化学腐蚀比化学腐蚀更普遍B.用铝质铆钉铆接铁板,铁板易被腐蚀C.钢铁在干燥空气...
- 下列叙述正确是( )A.酶具有很强的催化作用,胃蛋白酶只能催化蛋白质的水解,348 K时活性更强B.医疗上的血液透析利用了胶...
- (Ⅰ)如图所示,铁处于Ⅰ、Ⅱ、Ⅲ三种不同的环境中,铁被腐蚀的速率由大到小的顺序是(填序号)______.(Ⅱ)据报道,全世界每年...
- Ⅰ.用导线将A、B两装置的四个电极进行连接,使a极析出铜。回答有关问题。(1)导线将容器A和B连接时,Zn接 ,Cu接 (填“a”或“b...
- 下列事实中,与电化学腐蚀无关的是A.轮船水线以下的船壳上镶嵌有一定量的锌块B.镀锌的铁制品比镀锡的铁制品耐用C.埋在潮湿...
- 表面镀有保护金属层的铁片,当镀层有破损时比普通铁片更易腐蚀的是( )A.白铁(镀锌铁)B.马口铁(镀锡铁)C.镀铅铁D.镀...
- 如图所示,铁处于Ⅰ、Ⅱ、Ⅲ三种不同的环境中,铁被腐蚀的速率由大到小的顺序是(填序号)______.
- 某研究小组为测定食用白醋中醋酸的含量进行如下操作,其中正确的是[ ]A.用碱式滴定管量取一定体积的待测白醋放入锥形瓶中B....