本试题 “钢铁“发蓝”是将钢铁制品浸到某些氧化性的溶液中,在钢铁的表面形成一层四氧化三铁的技术过程。其中一种办法是将钢铁制品浸到亚硝酸钠和浓氢氧化钠的混合溶液...” 主要考查您对氧化剂、还原剂
氧化还原反应的定义
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 氧化剂、还原剂
- 氧化还原反应的定义
(1)定义:得到电子(或电子对偏向)的物质,在反应时所含元素的化合价降低。
(2)常见的氧化剂:
①活泼非金属单质:如 Cl2、Br2、O2等。
②某些高价氧化物,如SO3、MnO2等。
③氧化性含氧酸,如 浓H2SO4、HNO3、HClO等
④元素(如Mn、Cl、Fe等)处于高化合价时的盐,如KMnO4、K2Cr2O7、KClO3、FeCl3等。
⑤过氧化物,如Na2O2、H2O2等。
⑥某些金属阳离子:如Ag+、Fe3+等
还原剂:
(1)定义:失去电子(或电子对偏离)的物质,在反应时所含元素的化合价升高。
(2)常见的还原剂:
①活泼金属单质:如 Na、A1、Zn、Fe等。
②低价态的金属阳离子:如Fe2+等;
③某些非金属单质:如 H2、C等。
④元素(如C、S等)处于低价时的氧化物,如CO、NO、SO2等。
⑤元素(如Cl、S等)处于低化合价时的氢化物:如 H2S、HCl、HI、NH3等 。
⑥元素(如S、Fe等)处于低化合价时的盐或酸,如Na2SO3、H2SO3、H2C2O4、FeSO4等。
常见的氧化剂及对应的还原产物:
|
氧化剂 |
还原产物 |
| Cl2、ClO- | Cl- |
| KMnO4(H+)、MnO2 | Mn2+ |
| HNO3 | NOx、N2、NH4+ |
| 浓H2SO4 | SO2 |
| Ag+、Fe3+ | Ag、Fe2+ |
| H2O2 | H2O |
常见的还原剂及对应的氧化产物:
|
还原剂 |
氧化产物 |
|
Na、K等金属单质 |
Na+、K+ |
|
某些非金属C、S |
CO2、SO2 |
|
非金属的氢化物CH4、H2S、NH3等 |
CO2、S/SO2、NO |
|
某些低价态的氧化物CO、SO2 |
CO2、SO3 |
|
某些低价态的酸或盐H2SO3、Na2SO3等 |
SO42- |
|
某些低价态的阳离子Fe2+ |
Fe3+ |
|
H2O2 |
O2 |
易错易混点:
(1)金属单质只具有还原性,金属最高价阳离子只具有氧化性,处于中间价态的物质既有氧化性,又有还原性;
(2)非金属单质常作氧化剂,某些非金属单质也是较强的还原性物质,比如H2、C等等
(3)元素化合价的变化:
①元素最低价只有还原性,最高价只有氧化性,中间价态既有氧化性又有还原性
②同一元素在反应中化合价发生变化,只能接近不能交叉。
例如: 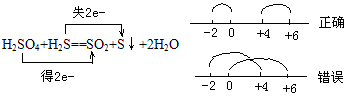
氧化还原反应:
有电子转移(得失或偏移)的反应;(无电子转移(得失或偏移)的反应为非氧化还原反应)
反应历程:
氧化还原反应前后,元素的氧化数发生变化。根据氧化数的升高或降低,可以将氧化还原反应拆分成两个半反应:氧化数升高的半反应,称为氧化反应;氧化数降低的反应,称为还原反应。氧化反应与还原反应是相互依存的,不能独立存在,它们共同组成氧化还原反应。
氧化还原反应中存在以下一般规律:
强弱律:氧化性:氧化剂>氧化产物;
还原性:还原剂>还原产物。
价态律:元素处于最高价态,只具有氧化性;元素处于最低价态,只具有还原性;处于中间价态,既具氧化性,又具有还原性。
转化律:同种元素不同价态间发生归中反应时,元素的氧化数只接近而不交叉,最多达到同种价态。
优先律:对于同一氧化剂,当存在多种还原剂时,通常先和还原性最强的还原剂反应。守恒律:氧化剂得到电子的数目等于还原剂失去电子的数目。
氧化还原性的强弱判定:
物质的氧化性是指物质得电子的能力,还原性是指物质失电子的能力。物质氧化性、还原性的强弱取决于物质得失电子的能力(与得失电子的数量无关)。从方程式与元素性质的角度,氧化性与还原性的有无与强弱可用以下几点判定:
(1)从元素所处的价态考虑,可初步分析物质所具备的性质(无法分析其强弱)。最高价态——只有氧化性,如H2SO4、KMnO4中的S、Mn元素;最低价态,只有还原性,如Cl-、S2-等;中间价态——既有氧化性又有还原性,如Fe、S、SO2等。
(2)根据氧化还原的方向判断:氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物。
(3)根据反应条件判断:当不同的氧化剂与同一种还原剂反应时,如氧化产物中元素的价态相同,可根据反应条件的高、低进行判断,如是否需要加热,是否需要酸性条件,浓度大小等等。
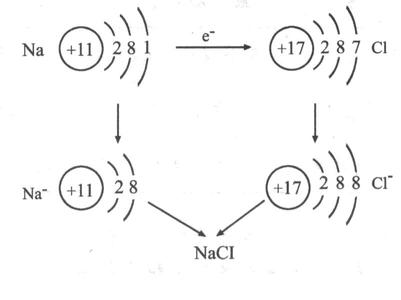
电子的得失过程:

其过程用核外电子排布变化情况可表示为:
与“钢铁“发蓝”是将钢铁制品浸到某些氧化性的溶液中,在钢铁的表...”考查相似的试题有:
- 在一些特定的条件下,铁也可以生成具有保护作用的氧化膜。例如,铁在浓硝酸、浓硫酸中可以生成氧化膜(称为钝化膜),在碱性溶...
- 某科研小组用MnO2和浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理。(1)请完成SO2与过量NaOH溶液反...
- MnO2和Zn是制造干电池的重要原料,工业上用软锰矿和闪锌矿联合生产MnO2和Zn的基本步骤为:(1)软锰矿、闪锌矿与硫酸共热:MnO2...
- LiAlH4()、LiH既是金属储氢材料又是有机合成中的常用试剂,遇水均能剧烈分解释放出H2,LiAlH4在125 ℃分解为LiH、H2和Al。下列...
- 下列说法正确的是( )A.阳离子只有氧化性,阴离子只有还原性B.失电子难的原子获得电子的能力一定强C.得到电子越多的氧化...
- 氯化碘(ICl)与Cl2性质相似,可发生下列反应,①2ICl+2Mg═MgI2+MgCl2②ICl+H2O═HCl+HIO.对上述两个反应的有关说法正确的是( ...
- 某一反应体系中有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2.已知该反应中H2O2只发生如下过程:H2O2-→O2...
- 下列反应中,既是化合反应,又是氧化还原反应的是( )①过氧化钠与水反应 ②钠在氧气中燃烧 ③氧化钙与水反应 ④CO燃烧 ⑤铁粉与F...
- 在2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O反应中(1)______是还原剂,______是还原产物.(2)该反应的离子方程式为:__...
- 某元素在化学反应中由游离态变为化合态,则该元素( )A.一定被氧化B.一定被还原C.既不可能被氧化,又不可能被还原D.既可...