本试题 “下列推理得出的相关结论合理的是[ ]A.原子和分子都是构成物质的微观粒子,所以原子和分子在化学变化中均不能再分B.化合物是由不同种元素组成的纯净物,所以...” 主要考查您对构成物质的微粒(分子、原子、离子)
氧化物
金刚石、石墨、C60的结构和用途
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 构成物质的微粒(分子、原子、离子)
- 氧化物
- 金刚石、石墨、C60的结构和用途
构成物质的微粒:
分子、原子、离子是构成物质的基本微粒。
分子,原子,离子的比较:
分子和原子的比较:
原子与离子的比较:
分子、原子、离子是构成物质的基本微粒。
分子,原子,离子的比较:
| 分子 | 原子 | 离子 | |
| 概念 | 保持物质化学性质的最小粒子 | 是化学变化中的最小粒子 | 带电的原子或原子团 |
| 表示方法 | 用化学式表示. 如H2,He | 用元素符号表示,如H,Fe | 用离子符号表示,如Na+、NO3- |
| 微粒的运动 | 物理变化是分子运动的结果,如:水的蒸发 | 化学变化是原子运动的结果. 如:水的电解 | 离子运动的结果可能是物理变化。也可能是化学变化,如:NaCl的溶解是物理变化, NaCl与AgNO3反应是化学变化 |
| 化学计量数与符号的关系 | 化学式、元素符号、离子符号前加上化学计量数,如2H,2H2,3Na+,只表示原子、分子、离了的“个数”,不表示元素和物质 | ||
| 联系 |  | ||
分子和原子的比较:
| 原子 | 分子 | |
| 定义 | 化学变化中的最小粒子 | 保持物质(由分子直接构成的物质)化学性质的最小粒子 |
| 相同点 | ①都是构成物质的基本粒子,有些物质是由分子构成的.有些物质是由原子直接构成的; ②都很小,但者阶一定的体积和质量; ③都在不断地运动; ④微粒子间都有间隔; ⑤都能保持物质的化学性质 | |
| 区别 | 化学变化中不能再分 | 化学变化中可以再分 |
| 如:在电解水实验中,水分子可以分成氢原子和氧原子,而氢原子和氧原子不可以再分,只是重新组合成氢分子、氧分子 | ||
| 同种原子具有相同的质子数 | 同种分子化学性质相同 | |
| 联系 |  | |
原子与离子的比较:
| 原子 | 离子 | |
| 概念 | 化学变化中最小粒子 | 带电荷的原子或原子团 |
| 电性 | 呈电中性,不带电 | 带电: 阳离子带正电 阴离子带负电 |
| 表示方法 | 用元素符号表示;Na 表示钠原子,2Na表示2个钠原子 | 在元素符号右上角先写电荷数,后标出电性 (+、-):Na+表示钠离子,2Na+表示2个钠离子 |
| 数量关系 | 核内质子数=核外电子数 | 阳离子:核内质子数> 核外电子数 阴离子:核内质子数< 核外电子数 |
| 相似点 | 都是构成物质的一种粒子 | |
| 转化 |  | |
氧化物:
1.定义:由两种元素组成,其中一种是氧元素的化合物(即由氧元素和另一种元素组成的化合物)。
2.分类:
(1)根据组成分类:
金属氧化物,如Na2O,CuO等
非金属氧化物,如CO2,NO等
(2)根据性质分类:
①酸性氧化物
能和碱反应生成盐和水的氧化物如CO2,SO3等
②碱性氧化物
能和酸反应生成盐和水的氧化物如CaO、Fe2O3等
③两性氧化物(初中不作要求)
④不成盐氧化物
不能直接反应生成盐的氧化物如CO,NO等
金属氧化物性质小结:
1.与水反应生成碱(可溶性金属氧化物)
Na2O+H2O==2NaOH
CaO+H2O==Ca(OH)2
2.与强酸反应
CaO+2HCI==CaCl2+H2O
Fe2O3+6HCl==2FeCl3+3H2O
Fe2O3+3H2SO4==Fe2(SO)3+3H2O
CuO+2HCl==CuCl2+H2O
CuO+H2SO4==CuSO4+H2O
3.与H2、CO或C反应
CuO+H2==Cu+H2O
2CuO+C==2Cu+CO2↑
CuO+CO==Cu+CO2
Fe2O3+3H2==2Fe+3H2O
2Fe2O3+3C==4Fe+3CO2↑
Fe2O3+3CO==2Fe+3CO2
Fe3O4+4H2==3Fe+4H2O
Fe3O4+2C==3Fe+2CO2↑
Fe3O4+4CO==3Fe+4CO2
非金属氧化物性质小结:
1.部分非金属氧化物与水反应生成相应的酸
CO2+H2O==H2CO3
SO2+H2O==H2SO3
2.与碱反应生成盐和水
Ca(OH)2+CO2==CaCO3↓+H2O
2NaOH+CO2==Na2CO3+H2O
Ca(OH)2+SO2==CaSO3↓+H2O
2NaOH+SO2==Na2SO3+H2O
易错点:
①酸性氧化物多数是非金属氧化物,但也可能是金属氧化物(如Mn2O7);碱性氧化物肯定是金属氧化物。
②非金属氧化物一般都是酸性氧化物,但H2O、CO、NO等不是酸性氧化物。
过氧化物:
常见的过氧化物有过氧化氢(H2O2)、过氧化钠 (Na2O2)。
过氧化氢俗称双氧水,在催化剂的催化作用下能分解生成水和氧气,常用于实验室制取氧气。过氧化氢具有极强的氧化性,可用作杀菌剂,漂白剂。
过氧化钠能与二氧化碳反应:2Na2O2+2CO2== 2Na2CO3+O2,根据该性质,可将过氧化钠用在坑道、潜艇或宁宙飞船等缺氧的场所,将人们呼出的CO2转换成O2,供给呼吸。
1.定义:由两种元素组成,其中一种是氧元素的化合物(即由氧元素和另一种元素组成的化合物)。
2.分类:
(1)根据组成分类:
金属氧化物,如Na2O,CuO等
非金属氧化物,如CO2,NO等
(2)根据性质分类:
①酸性氧化物
能和碱反应生成盐和水的氧化物如CO2,SO3等
②碱性氧化物
能和酸反应生成盐和水的氧化物如CaO、Fe2O3等
③两性氧化物(初中不作要求)
④不成盐氧化物
不能直接反应生成盐的氧化物如CO,NO等
金属氧化物性质小结:
1.与水反应生成碱(可溶性金属氧化物)
Na2O+H2O==2NaOH
CaO+H2O==Ca(OH)2
2.与强酸反应
CaO+2HCI==CaCl2+H2O
Fe2O3+6HCl==2FeCl3+3H2O
Fe2O3+3H2SO4==Fe2(SO)3+3H2O
CuO+2HCl==CuCl2+H2O
CuO+H2SO4==CuSO4+H2O
3.与H2、CO或C反应
CuO+H2==Cu+H2O
2CuO+C==2Cu+CO2↑
CuO+CO==Cu+CO2
Fe2O3+3H2==2Fe+3H2O
2Fe2O3+3C==4Fe+3CO2↑
Fe2O3+3CO==2Fe+3CO2
Fe3O4+4H2==3Fe+4H2O
Fe3O4+2C==3Fe+2CO2↑
Fe3O4+4CO==3Fe+4CO2
非金属氧化物性质小结:
1.部分非金属氧化物与水反应生成相应的酸
CO2+H2O==H2CO3
SO2+H2O==H2SO3
2.与碱反应生成盐和水
Ca(OH)2+CO2==CaCO3↓+H2O
2NaOH+CO2==Na2CO3+H2O
Ca(OH)2+SO2==CaSO3↓+H2O
2NaOH+SO2==Na2SO3+H2O
易错点:
①酸性氧化物多数是非金属氧化物,但也可能是金属氧化物(如Mn2O7);碱性氧化物肯定是金属氧化物。
②非金属氧化物一般都是酸性氧化物,但H2O、CO、NO等不是酸性氧化物。
过氧化物:
常见的过氧化物有过氧化氢(H2O2)、过氧化钠 (Na2O2)。
过氧化氢俗称双氧水,在催化剂的催化作用下能分解生成水和氧气,常用于实验室制取氧气。过氧化氢具有极强的氧化性,可用作杀菌剂,漂白剂。
过氧化钠能与二氧化碳反应:2Na2O2+2CO2== 2Na2CO3+O2,根据该性质,可将过氧化钠用在坑道、潜艇或宁宙飞船等缺氧的场所,将人们呼出的CO2转换成O2,供给呼吸。
金刚石:
金刚石俗称“金刚钻”。也就是我们常说的钻石,它是一种由纯碳组成的矿物。金刚石是自然界中最坚硬的物质。金刚石的用途非常广泛,例如:工艺品、工业中的切割工具。碳可以在高温、高压下形成金刚石。

石墨:
石墨是元素碳的一种同素异形体,每个碳原子的周边连结著另外三个碳原子(排列方式呈蜂巢式的多个六边形)以共价键结合,构成共价分子。由于每个碳原子均会放出一个电子,那些电子能够自由移动,因此石墨属于导电体。石墨是其中一种最软的矿物,它的用途包括制造铅笔芯和润滑剂。

C60:
C60分子是一种由60个碳原子构成的分子,它形似足球,因此又名足球烯。(C60这种物质是由C60分子组成的,而不是由原子构成的。) C60是单纯由碳原子结合形成的稳定分子,它具有60个顶点和32个面,其中12个为正五边形,20个为正六边形。其相对分子质量约为720。
人造金刚石:
20世纪80年代,人们发现人造金刚石在半导体制造行业具有广泛的应用前景。因为计算机芯片的基体材料—硅的导热性不好,这成为进一步提高芯片性能的难题。而金刚石在导热性方而远远超过硅(甚至超过铜和银),于是它成了芯片基体材料的最佳选择。正是这种需求推动了人造金刚石的研究。
碳纤维:
碳纤维是一种纤维状碳材料,它是将有机纤维与塑料树脂结合在一起,放在惰性气氛中,在一定压强下加强热、炭化而成的。碳纤维是一种强度比钢大,密度比铝小,比不锈钢还耐腐蚀,比耐热钢还耐高温,又能如铜那样导电,具有电学、热学和力学性能的新型材料。用碳纤维与塑料制成的复合材料,可以代替铝合金来制造飞机。制成的飞机,不仅轻巧,而且消耗动力少、推力大、噪音小。用碳纤维制电子计算机的磁盘,能提高计算机的贮存量和运算速率。用碳纤维增强塑料来制造卫星和火箭等宇宙飞行器,机械强度高,质量小,可节省大量的燃料。总之,用碳纤维或碳纤维增强的塑料、玻璃、陶瓷和金属等材料来代替钢材和合金等,在化工、机电、造船,特别是飞机制造、宇航器材等领域中有广泛的应用。
金刚石俗称“金刚钻”。也就是我们常说的钻石,它是一种由纯碳组成的矿物。金刚石是自然界中最坚硬的物质。金刚石的用途非常广泛,例如:工艺品、工业中的切割工具。碳可以在高温、高压下形成金刚石。

石墨:
石墨是元素碳的一种同素异形体,每个碳原子的周边连结著另外三个碳原子(排列方式呈蜂巢式的多个六边形)以共价键结合,构成共价分子。由于每个碳原子均会放出一个电子,那些电子能够自由移动,因此石墨属于导电体。石墨是其中一种最软的矿物,它的用途包括制造铅笔芯和润滑剂。

C60:
C60分子是一种由60个碳原子构成的分子,它形似足球,因此又名足球烯。(C60这种物质是由C60分子组成的,而不是由原子构成的。) C60是单纯由碳原子结合形成的稳定分子,它具有60个顶点和32个面,其中12个为正五边形,20个为正六边形。其相对分子质量约为720。
金刚石,石墨,碳60性质及用途比较
| 名称 | 金刚石 | 石墨 | 碳60 |
| 外观 | 纯净无色透明,正八 面体形状的晶体 |
深灰色,有金属光泽,不 透明的细鳞片状的固体, 质软,有滑腻感 |
分子型似足球状, 有金属光泽,其微晶 粉末呈黄色 |
| 结构模型 | 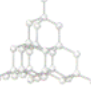 |
 |
 |
| 导电性 | 几乎不导电 | 良好 | 几乎不导电 |
| 硬度 | 天然存在的最硬物质 | 质软 | 质脆 |
| 导热性 | 很差 | 良好 | 很差 |
| 熔点 | 很高 | 很高 | 较低 |
| 用途 | 钻头,刻刀,装饰品 | 电极,铅笔芯,润滑剂 | 制备新材料,新配 件,医学应用 |
| 区别与联系 | 金刚石、石墨,C60,,的物理性质有很大差异,原因是这些单质中碳原子的排列方式不同,但由于它们都是由碳元素组成的单质,故化学性质相同。金刚石与石墨通过化学反应可以相互转变。 | ||
人造金刚石:
20世纪80年代,人们发现人造金刚石在半导体制造行业具有广泛的应用前景。因为计算机芯片的基体材料—硅的导热性不好,这成为进一步提高芯片性能的难题。而金刚石在导热性方而远远超过硅(甚至超过铜和银),于是它成了芯片基体材料的最佳选择。正是这种需求推动了人造金刚石的研究。
碳纤维:
碳纤维是一种纤维状碳材料,它是将有机纤维与塑料树脂结合在一起,放在惰性气氛中,在一定压强下加强热、炭化而成的。碳纤维是一种强度比钢大,密度比铝小,比不锈钢还耐腐蚀,比耐热钢还耐高温,又能如铜那样导电,具有电学、热学和力学性能的新型材料。用碳纤维与塑料制成的复合材料,可以代替铝合金来制造飞机。制成的飞机,不仅轻巧,而且消耗动力少、推力大、噪音小。用碳纤维制电子计算机的磁盘,能提高计算机的贮存量和运算速率。用碳纤维增强塑料来制造卫星和火箭等宇宙飞行器,机械强度高,质量小,可节省大量的燃料。总之,用碳纤维或碳纤维增强的塑料、玻璃、陶瓷和金属等材料来代替钢材和合金等,在化工、机电、造船,特别是飞机制造、宇航器材等领域中有广泛的应用。
发现相似题
与“下列推理得出的相关结论合理的是[ ]A.原子和分子都是构成物...”考查相似的试题有:
- 下列说法不正确的是( )A.原子的质量几乎都集中在原子核中B.原子、离子通过得失电子可以互相转变C.原子、分子、离子都是...
- 用分子的观点解释下列现象,不合理的是A.汽油挥发——分子大小发生了变化B.酒精燃烧——分子发生了变化C.干冰升华——分子间的间...
- (2011年湖南株洲,12题) 如图是地壳中各元素的含量(质量分数)图,据此判断下列说法正确的是( )A.含量最多的元素是非金属元...
- 从微观的角度认识物质及其变化,更有助于了解物质组成及变化的本质。(1)填写下表。铝原子结构示意图,在化学反应中铝原子一...
- 我们学习化学以后就要用化学的观点看待我们身边的各种物质.请你写出一种你最熟悉的物质______,该物质的化学式______,从物...
- 已知反应前后分子变化的微观示意图如下所示。下列说法错误的是A.化学方程式为CH4+2O2CO2+2H2OB.此反应为置换反应C.化学反...
- (2分)物质的分类标准有多种,自拟两个分类标准,将氢气、氧气、二氧化碳、铁四种物质中的三种物质包括在标准内,而另一种物...
- 臭氧(O3)主要分布在距地面10-20Km的高空,它能吸收大部分紫外线,保护地球生物。由臭氧分子构成的物质属于A.纯净物B.混...
- 碳和碳的化合物都是非常重要的物质。(1)碳原子的结构示意图为,碳原子的核电荷数是_______。(2)碳的单质有多种,具有下列结构...
- 选择下列A~E物质回答下列问题(用序号填空):A.钛合金 B.酒精 C.金刚石 D.氢氧化钠 E.干冰(1) 是一种可再生的绿色能...