本试题 “电石中的碳化钙和水能完全反应:CaC2+2H2O=C2H2↑+Ca(OH)2使反应产生的气体排水,测量排出水的体积,可计算出标准状况下乙炔的体积,从而可测定电石中碳化钙的...” 主要考查您对测定物质组成、成分含量
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 测定物质组成、成分含量
定量实验介绍:

燃烧法测定氨基酸的组成:
实验室用燃烧法测定某种氨基酸(CxHyOzNp)的分子组成。取Wg该种氨基酸放在纯氧中充分燃烧,生成CO2、H2O和N2。现按下图所示装置进行实验。

①实验开始时,首先要通入一段时间的氧气,目的是排除体系中的N2。
②D装置的作用是吸收未反应的O2,保证最终收集的气体是N2。
③读取N2体积时,应注意:量筒内液面与广口瓶中的液面相持平视线与凹液面最低处相切。
④实验中测得N2的体积为VmL(已折算为标准状况)。为确定此氨基酸的分子式,还需要的有关数据为生成二氧化碳气体的质量、生成水的质量、氨基酸的相对分子质量
用氨气还原氧化铜的方法测定铜的近似相对原子质量:
实验室用氨气还原氧化铜的方法测定铜的近似相对原子质量,反应的化学方程式为:2NH3+3CuO
 N2+3Cu+3H2O
N2+3Cu+3H2O(1)如果选用测定反应物CuO和生成物H2O的质量[m(CuO)、m(H2O)]时,请用下列仪器设计一个简单的实验方案。
装置图:
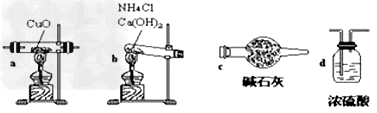
①连接顺序为:bcacd
②d中浓硫酸的作用是吸收未反应的氨、防止空气中水分进入;实验完毕时观察到a中的现象是固体由黑色转变为红色;
③Cu的相对原子质量的表达式
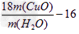
发现相似题
与“电石中的碳化钙和水能完全反应:CaC2+2H2O=C2H2↑+Ca(OH)2使反...”考查相似的试题有:
- 草酸晶体的组成可用H2C2O4•5H2O表示,为了测定某草酸样品中草酸晶体的纯度,进行如下实验:称取Wg草酸晶体,配成100.00mL水溶...
- A~F六种元素中,除A外均为短周期元素,它们的原子结构或性质如表所示(1)A的某种氯化物的浓溶液可用于制作Cu印刷电路板,写出...
- 某气体由常见的一种或多种气体组成,经测定其中只含有碳、氧两种元素,碳、氧元素的质量比为1:2,则关于该气体的说法正确的...
- 已知某白色混合物粉末中含有 Al2(SO4)3、Na2SO4、NH4HCO3、NH4Cl、KCl五种物质中的两种.请完成下述探究混合物组成的实验限...
- 黄铜是一种铜锌合金,除含铜和锌外,还含有少量铅、铁等杂质。为了测定黄铜中铜的质量分数,设计实验步骤如下。①称取黄铜屑0....
- 有5瓶白色固体试剂,分别是Ba(NO3)2、KCl、NaOH、CuSO4、Na2SO4,现只提供蒸馏水,通过下面的实验步骤可鉴别它们.请填写下...
- 为确定某液态有机物X(分子式为C2H6O2)的结构,某同学准备按下列程序进行探究.已知: ①一个碳原子上连两个羟基()的物质不稳定...
- 在化学研究领域,经常需要对一些物质进行性质的确定。如利用下列装置(夹持仪器已略去)测出一定质量镁与盐酸反应放出的气体...
- 为测定某CuO和Cu2O的混合物中CuO的质量[m(CuO)],实验中测得如下数据: m-混合物的质量(g) m(H2O)-生成水的质量(g)m...
- 20.6gNH4HCO3和NaHSO3的干燥粉状混合物,用加热分解的实验方法来测定NH4HCO3的质量分数。已知:NaHSO3加热时会产生SO2。根据...