本试题 “下列有关说法正确的是[ ]A.CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H” 主要考查您对化学反应进行的方向
影响化学平衡的因素
水的离子积常数
金属的电化学腐蚀
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 化学反应进行的方向
- 影响化学平衡的因素
- 水的离子积常数
- 金属的电化学腐蚀
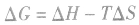 :
:1.化学反应进行方向的判据
(1)由稳定性弱的物质向稳定性强的物质转变
如
 ,稳定性
,稳定性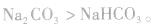
(2)离子反应总是向着使反应体系中某些离子浓度减小的方向进行
①溶解度大的物质向溶解度小的物质转变,如
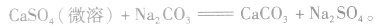
②由相对强酸(碱)向相对弱酸(碱)转变,如
 ,
,  所以酸性强弱:
所以酸性强弱: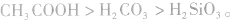
(3)由难挥发性物质向易挥发性物质转变
如
 所以沸点:
所以沸点: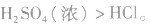
(4)由氧化性(还原性)强的物质向氧化性(还原性)弱的物质转变
如
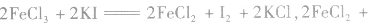
 ,则氧化性:
,则氧化性: 。
。 2.焓变和熵变共同判断反应的方向:
在温度、压强一定的条件下,自发反应总是向
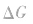
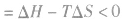 的方向进行,直至达到平衡状态;
的方向进行,直至达到平衡状态;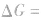
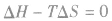 表明反应已达到平衡状态;
表明反应已达到平衡状态;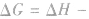
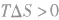 表明反应不能自发进行。
表明反应不能自发进行。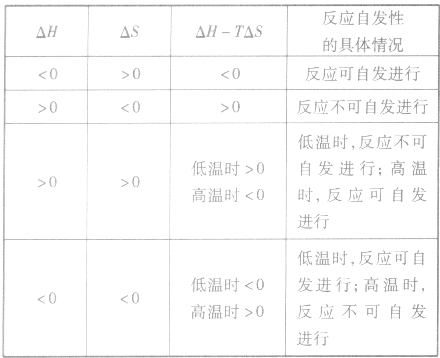
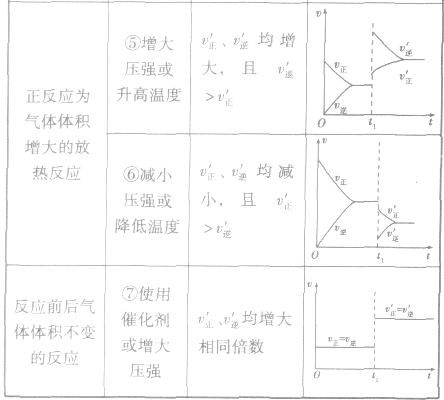
(1)浓度在其他条件不变的情况下,增大反应物的浓度或减小生成物的浓度,都可以使化学平衡向正反应方向移动;增大生成物的浓度或减小反应物的浓度,都可以使化学平衡向逆反应方向移动。
(2)压强对反应前后气体总体积发生变化的反应,在其他条件不变时,增大压强会使平衡向气体体积缩小的方向移动,减小压强会使平衡向气体体积增大的方向移动。对于反应
 来说,加压,
来说,加压,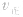 增大、
增大、 增大,
增大,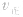 增大的倍数大,平衡向正反应方向移动:若减压,
增大的倍数大,平衡向正反应方向移动:若减压,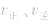 均减小,
均减小,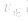 减小的倍数大,平衡向逆反应方向移动,加压、减压后v一t关系图像如下图:
减小的倍数大,平衡向逆反应方向移动,加压、减压后v一t关系图像如下图: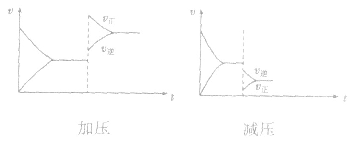
(3)温度在其他条件不变时,温度升高平衡向吸热反应的方向移动,温度降低平衡向放热反应的方向移动
对于
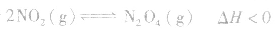 ,加热时颜色变深,降温时颜色变浅。该反应升温、降温时,v—t天系图像如下图:
,加热时颜色变深,降温时颜色变浅。该反应升温、降温时,v—t天系图像如下图: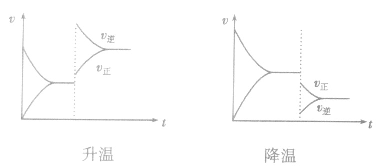
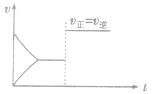
(4)催化剂由于催化剂能同等程度地改变正、逆反应速率,所以催化剂对化学平衡无影响,v一t图像为
稀有气体对化学反应速率和化学平衡的影响分析:
1.恒温恒容时
充入稀有气体
 体系总压强增大,但各反应成分分压不变,即各反应成分的浓度不变,化学反应速率不变,平衡不移动。
体系总压强增大,但各反应成分分压不变,即各反应成分的浓度不变,化学反应速率不变,平衡不移动。 2.恒温恒压时
充入稀有气体
 容器容积增大
容器容积增大 各反应成分浓度降低
各反应成分浓度降低 反应速率减小,平衡向气体体积增大的方向移动。
反应速率减小,平衡向气体体积增大的方向移动。3.当充入与反应无关的其他气体时,分析方法与充入稀有气体相同。
化学平衡图像:
1.速率一时间因此类图像定性揭示了
 随时间(含条件改变对化学反应速率的影响)变化的观律,体现了平衡的“动、等、定、变”的基本特征,以及平衡移动的方向等。
随时间(含条件改变对化学反应速率的影响)变化的观律,体现了平衡的“动、等、定、变”的基本特征,以及平衡移动的方向等。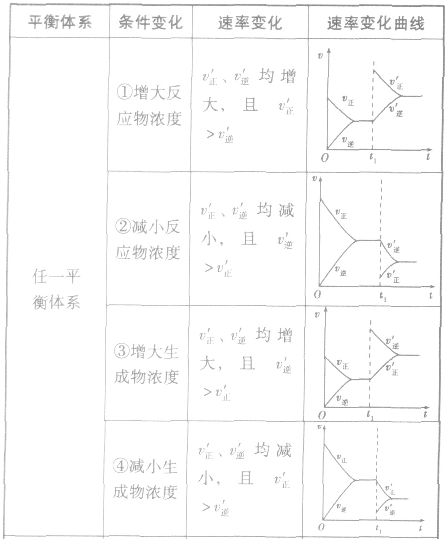
2.含量一时间一温度(压强)图常见的形式有下图所示的几种(C%指某产物百分含量,B%指某反应物百分含量),这些图像的折点表示达到平衡的时间,曲线的斜率反映了反应速率的大小,可以确定T(p)的高低(大小),水平线高低反映平衡移动的方向。

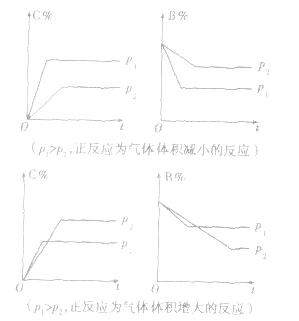
3.恒压(温)线该类图像的纵坐标为物质的平衡浓发(c)或反应物的转化率(α),横坐标为温度(T)或压强 (p),常见类型如下图:
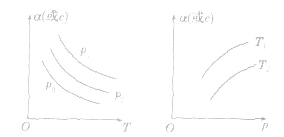
小结:
1.图像分析应注意“三看”
(1)看两轴:认清两轴所表示的含义。
(2)看起点:从图像纵轴上的起点,一般可判断谁为反应物,谁为生成物以及平衡前反应进行的方向。
(3)看拐点:一般图像在拐点后平行于横轴则表示反应达平衡,如横轴为时间,由拐点可判断反应速率。
2.图像分析中,对于温度、浓度、压强三个因素,一般采用“定二议一”的方式进行分析
平衡移动方向与反应物转化率的关系:
1.温度或压强改变引起平衡向正反应方向移动时,反应物的转化率必然增大。
2.反应物用量的改变
(1)若反应物只有一种时,如aA(g)
 bB(g)+ cc(g),增加A的量,平衡向正反应方向移动,但反应物 A的转化率与气体物质的化学计量数有关:
bB(g)+ cc(g),增加A的量,平衡向正反应方向移动,但反应物 A的转化率与气体物质的化学计量数有关:
(2)若反应物不止一种时,如aA(g)+bB(g)
 cC(g)+dD(g):
cC(g)+dD(g): a.若只增加A的量,平衡向正反应方向移动,而A的转化率减小,B的转化率增大。
b.若按原比例同倍数的增加反应物A和B的量,则平衡向正反应方向移动,而反应物的转化率与气体物质的计量数有关:

c.若不同倍增加A、B的量,相当于增加了一种物质,同a。
3.催化剂不改变转化率。
4.反应物起始的物质的量之比等于化学计量数之比时,各反应物转化率相等。
浓度、压强影响化学平衡的几种特殊情况:
1.当反应混合物中存在固体或纯液体物质时,由于其“浓度”是恒定的,不随其量的增减而变化,故改变这些固体或纯液体的量,对平衡基本无影响。
2.南于压强的变化对非气态物质的浓度基本无影响,因此,当反应混合物中不存在气态物质时,压强的变化对平衡无影响。
3.对于气体分子数无变化的反应,如
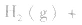
 ,压强的变化对其平衡无影响。这是因为,在这种情况下,压强的变化对正、逆反应速率的影响程度是等同的,故平衡不移动。
,压强的变化对其平衡无影响。这是因为,在这种情况下,压强的变化对正、逆反应速率的影响程度是等同的,故平衡不移动。 4.对于有气体参加的反应,同等程度地改变反应混合物中各物质的浓度,应视为压强对平衡的影响,如某平衡体系中,
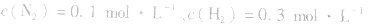 ,
,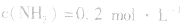 ,当浓度同时增大一倍时,即让
,当浓度同时增大一倍时,即让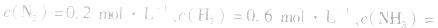
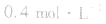 ,此时相当于压强增大一倍,平衡向生成NH3的方向移动。
,此时相当于压强增大一倍,平衡向生成NH3的方向移动。 5.在恒容的密闭容器中,当改变其中一种气体物质的浓度时,必然同时引起压强改变,但判断平衡移动的方向时,心仍从浓度的影响去考虑:如
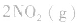
 ,平衡后,向容器中再通入反应物
,平衡后,向容器中再通入反应物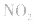 ,使 c(NO2)增大,平衡正向移动;如向容器中再通入生成物 N2O4,则使c(N2O4)增大,平衡逆向移动。但由于两种情况下,容器内的压强都增大,故对最终平衡状态的影响是一致的,如两种情况下,重新达到平衡后,NO2的百分含量都比原平衡时要小
,使 c(NO2)增大,平衡正向移动;如向容器中再通入生成物 N2O4,则使c(N2O4)增大,平衡逆向移动。但由于两种情况下,容器内的压强都增大,故对最终平衡状态的影响是一致的,如两种情况下,重新达到平衡后,NO2的百分含量都比原平衡时要小水的电离:
水是一种极弱的电解质,它能微弱地电离:
实验测得:25℃时,1L纯水中只有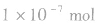 的水分子发生电离,故25℃时纯水中
的水分子发生电离,故25℃时纯水中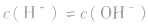

水的离子积:
在一定温度下,水电离出的c(H+)与c(OH-)的乘积是一个常数,称为水的离子积常数,简称水的离子积,用符号 表示,即
表示,即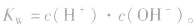
(1)在一定温度下,水的离子积都是一个常数,在25℃时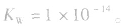
(2)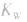 随温度的变化而变化,温度升高,
随温度的变化而变化,温度升高,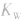 增大。
增大。
(3)水的离子积常数揭示了在任何水溶液中均存在水的电离平衡,都有 存在。在酸性或碱性的稀溶液中,当温度为25℃时,
存在。在酸性或碱性的稀溶液中,当温度为25℃时,
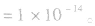
(4)在酸或碱的稀溶液中,由水电离出的c(H+)和c(OH-)总相等.即 如25℃时
如25℃时 或NaOH溶液中,
或NaOH溶液中,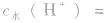
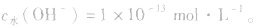
溶液中c(H+)或c(OH-)的计算:
常温下,稀溶液中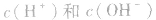 的乘积总是
的乘积总是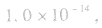 知道
知道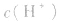 就可以计算出
就可以计算出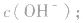 反之亦然
反之亦然
1.酸溶液
当在水中加入酸后,将使水的电离平衡向左移动 (抑制水的电离)。在酸的水溶液中,H+主要由酸电离产生,即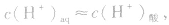 而OH-是由水电离产生的:
而OH-是由水电离产生的: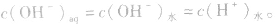
2.碱溶液
同理,在碱的水溶液中,OH-主要由碱电离产生,即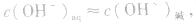 而H+是由水电离产生的:
而H+是由水电离产生的: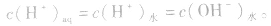
3.盐溶液
在盐的水溶液中,H+和OH-全部来自水的电离,且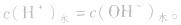
(1)若单一水解的盐的水溶液呈酸性,c(H+)> c(OH-),即弱碱阳离子水解


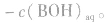
(2)若单一水解的盐的水溶液呈碱性,c(OH一)> c(H+),即弱酸阴离子水解
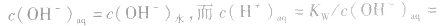
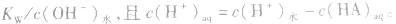
说明:由以上分析可以看出,在常温下(25℃):
酸(或碱)的溶液中,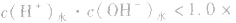
 发生水解的盐溶液中
发生水解的盐溶液中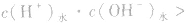
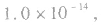 但
但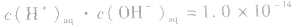 总成立。
总成立。
金属的腐蚀:
1.金属腐蚀的概念金属与周围的气体或液体物质发生氧化还原反应而引起损耗的现象。
2.金属腐蚀的实质金属原子(M)失去电子而被氧化的过程。
M-ne-==M n+
金属的电化学腐蚀:
不纯的金属或合金因发生原电池反应而造成的腐蚀。最普遍的钢铁腐蚀是:
负极:2Fe-4e-=2Fe2+
正极:O2+2H2O+4e-=4OH- (注:在少数情况下,若周围介质的酸性较强,正极的反应是:2H++2e-=H2↑)
金属的腐蚀以电化腐蚀为主.例如,钢铁生锈的主要过程为
(1)吸氧腐蚀:金属在酸性很弱或中性溶液里,空气里的氧气溶解于金属表面水膜中而发生的电化腐蚀。
①发生条件:水膜的酸性很弱或呈中性
②反应本质:形成原电池
③铁为负极,(氧化反应);正极反应:(还原反应)
(2)析氢腐蚀:在酸性较强的溶液中发生电化腐蚀时放出氢气,这种腐蚀叫做析氢腐蚀。
①发生条件:水膜的酸性较强
②反应本质:形成原电池
③铁为负极,(氧化反应);正极反应:(还原反应)
钢铁的电化学腐蚀的两种类型:


金属腐蚀快慢的判断:
金属腐蚀的快慢与下列两个因素有关:
(1)与构成原电池的材料有关,两极材料的活泼性差别越大,电动势越大,氧化还原反应的速率越快,活泼金属被腐蚀的速率就越快。
(2)与金属所接触的电解质溶液的性质有关,活泼金属在电解质溶液中的腐蚀快于在非电解质溶液中的腐蚀,在强电解质溶液中的腐蚀快于在弱电解质溶液中的腐蚀。一般来说,可用下列原则判断:电解原理引起的腐蚀>原电池原理引起的腐蚀> 化学腐蚀>有防护措施的腐蚀
与“下列有关说法正确的是[ ]A.CaCO3(s)=CaO(s)+CO2(g)室温下不...”考查相似的试题有:
- 在四个相等容积的密闭容器中各自进行如下反应:2SO2(g)+O2(g)2SO3(g) △H
- 恒压密闭容器中充入2 mol X和5 mol Y,发生反应:X(g)+3Y(g)2Z(g),温度分别为T1和T2时,X的转化率α(X) 随时间变化的关系如...
- (12分)向甲乙两个容积均为1 L的恒容容器中,分别充入2 mol A、2 mol B和1 mol A、1 mol B。相同条件下(温度T ℃),发生下列反...
- (8分)钾是—种活泼的金属,工业上通常用金属钠和氯化钾在高温下反应制取。该反应为:Na(l)+KCl(l)NaCl(l)+K(g)(...
- 合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响.合成氨反应的化学方程式为:N2(g)+3H2(g)2...
- 常温下,对于1L0.005mol·L-1硫酸表述中正确的是A.由水电离出的c(H+)=1.0×10-12mol·L-1B.加水稀释后,溶液中所有离子的...
- 常温下,对于①pH =12氨水②0.05 mol/L盐酸③pH =13的NaOH溶液④0.1 mol/L AlCl3溶液,下列说法正确的是A.①与②以体积比1:1混合,...
- 下列说法正确的是A.pH = 3的盐酸和pH = 5的硫酸等体积混合,pH = 4B.室温下,pH = 9的碱性溶液中,可能存在CH3COOH分子C....
- 25 ℃时,重水(D2O)的离子积为1.6×10-15,也可用pH一样的定义来规定其酸碱度:pD=-lgc(D+),下列有关pD的叙述正确的是①中性D...
- 钢铁在潮湿的空气中会被腐蚀,发生的原电池反应为:2Fe+2H2O+O2==2Fe2++4OH-。以下说法正确的是[ ]A.负极发生的反应为:F...