本试题 “在2.00L的密闭容器中,反应2A(g)⇌B(g)+C(g)分别在三种不同实验条件下进行,但起始浓度相同,均为c(A)=0.100mol/L、c(B)=0.020mol/L及c(C)=0.020m...” 主要考查您对达到化学平衡的标志
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 达到化学平衡的标志
化学平衡移动的含义:
1.当一个可逆反应达到平衡状态后,如果改变温度、压强、浓度等反应条件.原来的平衡状态会被破坏,化学平衡会发生移动,平衡混合物中各组成物质的质量分数也就随着改变,在一段时间后达到新的平衡状态,这种由原平衡状态向新平衡状态的变化过程。就是化学平衡的移动。以上过程可归纳如下:

2.化学平衡移动与化学反应速率的关系
当与化学平衡体系有天的外界条件改变以后,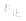 >
>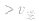 ,化学平衡向正反应方向移动;
,化学平衡向正反应方向移动; ,化学平衡不移动;
,化学平衡不移动;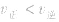 ,化学平衡向逆反应方向移动。
,化学平衡向逆反应方向移动。
化学平衡状态:
(1)定义:在一定条件下的可逆反应中,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态,叫做化学平衡状态,简称化学平衡。
(2)化学平衡的建立对于可逆反应,不管从正反应开始(只投入反应物),还是从逆反应开始(只投入生成物),或从正、逆反应同时开始(同时投入反应物和生成物),在一定条件下都会达到 的状态。当
的状态。当 相等时,单位时间内同一物质消耗与生成的量完全相等,因而各物质的浓度和百分含量保持一定,即达到化学平衡状态。构成化学平衡体系的基本要求是反应物和所有的生成物均处于同一反应体系中,反应条件(温度、浓度、压强等)保持不变。
相等时,单位时间内同一物质消耗与生成的量完全相等,因而各物质的浓度和百分含量保持一定,即达到化学平衡状态。构成化学平衡体系的基本要求是反应物和所有的生成物均处于同一反应体系中,反应条件(温度、浓度、压强等)保持不变。
化学平衡的特征:
(1)逆:只有可逆反应才能达到化学平衡状态。
(2)动:是动态平衡,正、逆反应仍在不断进行。
(3)等: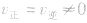 。
。
(4)定:各组分的浓度及百分含量保持一定。
(5)变:当影响化学平衡的外界条件发生变化使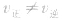 时,平衡便会发生移动而使各组分的浓度、百分含量发生变化,直至建立新的平衡。
时,平衡便会发生移动而使各组分的浓度、百分含量发生变化,直至建立新的平衡。
化学平衡状态的判断:
1.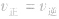 指的是同一物质的正反应速率与逆反应速率相等。
指的是同一物质的正反应速率与逆反应速率相等。
2.反应混合物中各组分的含量(质量分数、体积分数、物质的量分数)保持不变。
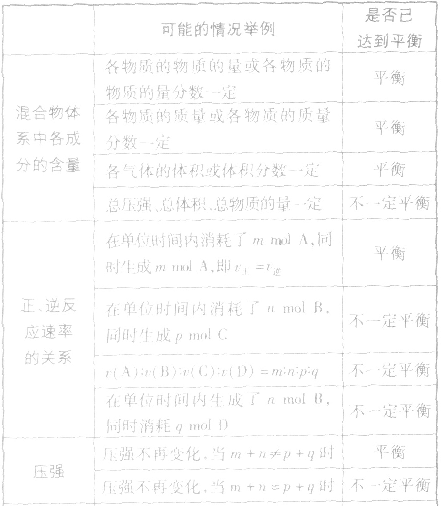
3.反应类型分析对于密闭容器中的反应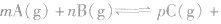 qD(g),根据对化学平衡概念的理解,判断下列各情况是否达到平衡。
qD(g),根据对化学平衡概念的理解,判断下列各情况是否达到平衡。

1.当一个可逆反应达到平衡状态后,如果改变温度、压强、浓度等反应条件.原来的平衡状态会被破坏,化学平衡会发生移动,平衡混合物中各组成物质的质量分数也就随着改变,在一段时间后达到新的平衡状态,这种由原平衡状态向新平衡状态的变化过程。就是化学平衡的移动。以上过程可归纳如下:

2.化学平衡移动与化学反应速率的关系
当与化学平衡体系有天的外界条件改变以后,
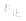 >
>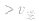 ,化学平衡向正反应方向移动;
,化学平衡向正反应方向移动; ,化学平衡不移动;
,化学平衡不移动;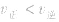 ,化学平衡向逆反应方向移动。
,化学平衡向逆反应方向移动。化学平衡状态:
(1)定义:在一定条件下的可逆反应中,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态,叫做化学平衡状态,简称化学平衡。
(2)化学平衡的建立对于可逆反应,不管从正反应开始(只投入反应物),还是从逆反应开始(只投入生成物),或从正、逆反应同时开始(同时投入反应物和生成物),在一定条件下都会达到
 的状态。当
的状态。当 相等时,单位时间内同一物质消耗与生成的量完全相等,因而各物质的浓度和百分含量保持一定,即达到化学平衡状态。构成化学平衡体系的基本要求是反应物和所有的生成物均处于同一反应体系中,反应条件(温度、浓度、压强等)保持不变。
相等时,单位时间内同一物质消耗与生成的量完全相等,因而各物质的浓度和百分含量保持一定,即达到化学平衡状态。构成化学平衡体系的基本要求是反应物和所有的生成物均处于同一反应体系中,反应条件(温度、浓度、压强等)保持不变。 化学平衡的特征:
(1)逆:只有可逆反应才能达到化学平衡状态。
(2)动:是动态平衡,正、逆反应仍在不断进行。
(3)等:
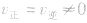 。
。(4)定:各组分的浓度及百分含量保持一定。
(5)变:当影响化学平衡的外界条件发生变化使
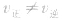 时,平衡便会发生移动而使各组分的浓度、百分含量发生变化,直至建立新的平衡。
时,平衡便会发生移动而使各组分的浓度、百分含量发生变化,直至建立新的平衡。化学平衡状态的判断:
1.
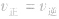 指的是同一物质的正反应速率与逆反应速率相等。
指的是同一物质的正反应速率与逆反应速率相等。 2.反应混合物中各组分的含量(质量分数、体积分数、物质的量分数)保持不变。
3.反应类型分析对于密闭容器中的反应
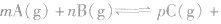 qD(g),根据对化学平衡概念的理解,判断下列各情况是否达到平衡。
qD(g),根据对化学平衡概念的理解,判断下列各情况是否达到平衡。

发现相似题
与“在2.00L的密闭容器中,反应2A(g)⇌B(g)+C(g)分别在三种...”考查相似的试题有:
- 下列说法正确的是( )A.用坩埚灼烧MgCl2·6H2O的反应式 MgCl2·6H2OMgCl2+6H2OB.根据下表提供的数据,等物质的量浓度的NaClO...
- (I)某化学家根据“原子经济”的思想,设计了如下制备H2的反应步骤:①CaBr2+H2OCaO+2HBr ②2HBr+HgHgBr2+H2③HgBr2+__________ +...
- 在一定条件下,一定量的A和B气体发生如下可逆反应:2A(g)+3B(g)3C(g),只有反应到达平衡时才具有的状态是( )A.各物...
- 一定温度下,恒容密闭容器中进行的反应:A(s)+3B(g)⇌2C(g)+D(g),下列物理量不能确定达到平衡状态的是( )A.各物质...
- 已知:N2(g)+3H2(g)2NH3(g);ΔH="-92.4" kJ·mol-1。请回答:(1)合成氨工业中采取的下列措施可以用勒夏特列原理解释的...
- (12分,每空2分)一定的条件下,在某一容积为2L的密闭容器内,物质A、B、C发生某种放热化学反应,反应中物质A、B、C的浓度随...
- 现代工业将煤炭气化,既可以提高燃料的利用率、减少CO、SO2等的排放,又可以扩大水煤气的广泛用途。⑴已知:2C(s)+O2(g)=2CO(...
- 某温度下,向一密闭的体积可变的容器中加入1molN2和3molH2,使之在一定条件下合成氨气。反应达到平衡后,测得平衡混合气体中...
- 在一密闭容器中,反应aA(g)bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则下...
- 在5 L的密闭容器中充入2 molA气体和1 mol B气体,在一定条件下发生如下反应:2A(g)+B(g)2C(g)。达平衡时,在相同温度下测得混...