本试题 “世界著名的科技史专家、英国剑桥大学的李约瑟博士考证说:“中国至少在距今3000年以前,就已经使用玻璃了 。”下列有关玻璃的说法不正确的是[ ]A.制普通玻璃的...” 主要考查您对硅酸盐
原子晶体
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 硅酸盐
- 原子晶体
①硅酸盐是构成地壳岩石的主要成分,其结构复杂,组成可用二氧化硅和金属氧化物的形式表示。例如:硅酸钠Na2SiO3(Na2O·SiO2);镁橄榄石Mg2SiO4(2MgO·SiO2);高岭石Al2(Si2O5)(OH)4(Al2O3·2SiO2·2H2O)
②云母、滑石、石棉、高岭石等,它们都属于天然的硅酸盐。
③人造硅酸盐:主要有玻璃、水泥、各种陶瓷、砖瓦、耐火砖、水玻璃以及某些分子筛等。
④硅酸盐制品性质稳定,熔点较高,难溶于水,有很广泛的用途。最简单硅酸盐是硅酸钠,其水溶液俗称水玻璃,是一种矿物胶,可作粘合剂,防腐剂。
硅酸钠:
(1)化学式:Na2SiO3
(2)俗称:其水溶液俗称水玻璃
(3)物理性质:硅酸钠溶液是无色黏稠液体
(4)化学性质:
①与盐酸反应 Na2SiO3+2HCl==== 2NaCl+H2SiO3(胶体)
②与CO2反应 NaSiO3+CO2+H2O ==Na2CO3+H2SiO3↓
③与水发生水解反应硅酸钠溶液显碱性
(5)制备:SiO2+2NaOH== Na2SiO3+H2O
(6)保存:试剂瓶不能配磨口玻璃塞
(7)用途:常用于制备硅胶和木材防火剂等
相邻原子间以共价键相结合而形成空间网状结构的晶体,熔沸点高,导热性、延展性不良,导电性差,硬度大。如:金刚石、石英。
晶体的基本类型与性质:
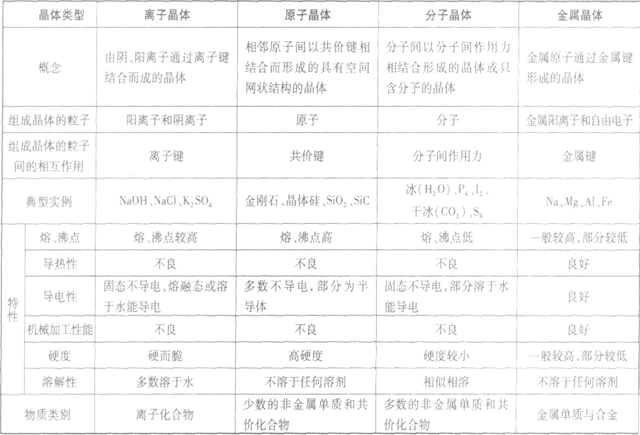
晶体熔、沸点高低的比较规律:
(1)不同类型晶体的熔、沸点高低规律:一般,原子晶体>离子晶体>分子晶体。金属晶体的熔、沸点有的很高,如钨、铂等;有的则很低,如汞、铯等。
(2)同种类型晶体,晶体内粒子间的作用力越大,熔、沸点越高。
①分子晶体:分子间作用力越大,物质的熔、沸点越高,反之越低。
a.组成和结构相似的分子,相对分子质量越大,范德华力越大,熔、沸点越高。如沸点:O2>N2、HI>HBI>HCl(含氢键的除外)。
b.相对分子质量相等或相近的分子,极性分子的范德华力大,熔、沸点高。如沸点:CO>N2。
c.含有氢键的分子熔、沸点比较高。如沸点:H2O >H2Te>H2Se>H2S,HF>HCl,NH3>PH3。
d.在烷烃的同分异构体中,一般来说,支链越多,熔、沸点越低。如沸点:正戊烷>异戊烷>新戊烷。芳香烃及其衍生物苯环上的同分异构体熔、沸点大小一般按照“邻位>问位>对位”的顺序。
e.在高级脂肪酸形成的油脂中,油的熔、沸点比脂肪低,烃基部分的不饱和程度越大(碳碳双键越多),熔、沸点越低,如:
(C17H35COO)3C3H5>(C17H33COO)3C3H5
硬脂酸甘油酯 油酸甘油酯
②原子晶体:要比较共价键的强弱。一般来说,原子半径越小,键长越短,键能越大,共价键越牢固,晶体的熔、沸点越高.如熔点:金刚石(C—C)>金刚砂 (Si—C)>晶体硅(Si—Si)>锗(Ge—Ge)。
③离子晶体:要比较离子键的强弱。一般来说,阴、阳离子电荷数越多,离子半径越小,离子键越强,熔、沸点越高,如熔点:MgO>NaCl,KF>KCl>KBr> KI。离子晶体的晶格能越大,其熔、沸点越高。
④金属晶体:要比较金属键的强弱。金属晶体中金属原子的价电子数越多,原子半径越小,金属阳离子与自由电子间的静电作用越强,金属键越强,熔、沸点越高,反之越低,如熔点:Na<Mg<Al。
(3)元素周期表中ⅦA族卤素的单质(分子晶体) 的熔、沸点随原子序数递增而升高;笫IA族碱金属元素的单质(金属晶体)的熔、沸点随原子序数的递增而降低。如熔、沸点:Li>Na>K>Rb>Cs。
注意:上述总结的是一般规律,不能绝对化。在具体比较晶体的熔、沸点高低时,应先弄清晶体的类型,然后根据不同类型晶体进行判断,但应注意具体问题具体分析。如MgO为离子晶体,[大]为离子半径小且离子电荷多,离子键较强,其熔点(2852℃)要高于部分原子晶体,如SiO2(1710℃)。
与“世界著名的科技史专家、英国剑桥大学的李约瑟博士考证说:“中...”考查相似的试题有:
- 将4.14 g Pb经充分氧化后得到氧化物的质量为4.46 g,则生成的氧化物化学式为A.PbO2B.Pb3O4C.PbOD.Pb2O5
- 实验室里保存下列试剂,其保存的方法和理由都正确的是( )编号试剂保存方法理由A氢氧化钠固体存放在带橡胶塞的广口瓶中防止...
- 1999年美国《科学》杂志报道:在40GPa高压下,用激光器加热到1800K,人们成功制得了原子晶体干冰,下列推断正确的是[ ]A.原...
- (10分)1915年诺贝尔物理学奖授予Henry Bragg和Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献。(一)科学...
- 下列物质中,属于分子晶体的是( )①二氧化硅 ②碘 ③食盐 ④蔗糖 ⑤磷酸A.②④⑤B.①②④C.②③④⑤D.①②③⑤
- 下列叙述错误的是( )A.范德华力是普遍存在的一种分子间作用力,属于电性作用B.范德华力比较弱,但范德华力越强,物质的熔点...
- 光导纤维被认为是20世纪最伟大的发明之一,2009年诺贝尔物理学奖授予被誉为“光纤之父”的华人科学家高锟。组成光导纤维的主要...
- 关于化学键的下列说法正确的是 ( )A.构成离子晶体的作用力可能是离子键也可能是共价键B.氯化铯晶体是由氯化铯分子构成的C...
- 氢元素与其他元素形成的二元化合物称为氢化物,下面关于氢化物的叙述正确的是
- 关于晶体和非晶体的说法,正确的是( )A.晶体在三维空间里呈周期性有序排列,因此在各个不同的方向上具有相同的物理性质B....