本试题 “如图是某学校实验室从化学试剂商店买回来的氢氧化钠试剂标签上的部分内容.某同学从该试剂瓶中取出24.0g固体,配成1L溶液,请计算:(1)所得氢氧化钠溶液的...” 主要考查您对化学反应方程式
物质的量浓度
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 化学反应方程式
- 物质的量浓度
化学方程式:
用化学式来表示化学反应的式子,叫做化学方程式。化学方程式不仅表明了反应物、生成物和反应条件,同时,通过相对分子质量或相对原子质量还可以表示个物质之间的质量关系,即各物质之间的质量比。
书写化学方程式要遵守两个原则:
一是必须以客观事实为基础,绝不能凭空臆想、臆造事实上不存在的物质和化学反应;
二是要遵守质量守恒定律,等号两边各原子种类与数目必须相等。
化学方程式的意义:
化学方程式不仅表明了反应物、生成物和反应条件。同时,化学计量数代表了各反应物、生成物物质的量关系,通过相对分子质量或相对原子质量还可以表示各物质之间的质量关系,即各物质之间的质量比。对于气体反应物、生成物,还可以直接通过化学计量数得出体积比。
物质的量浓度:
定义:单位体积的溶液里所含溶质B的物质的量,也称为B的物质的量浓度
符号:cB
单位:mol/L(mol·L -1)
计算公式:物质的量浓度(cB)=物质的量(n)/溶液的体积(V)
物质的量浓度与溶液质量分数、密度的关系:c=1000ρω/M
稀释定理:
- 稀释前后溶液中溶质的物质的量不变
c(浓溶液)V(浓溶液)=c(稀溶液)V(稀溶液) - 稀释前后溶液中溶质的质量不变
ρ(浓溶液)V(浓溶液)w%(浓溶液)=ρ(稀溶液)V(稀溶液)w%(稀溶液)
物质的量浓度与质量分数(质量百分比浓度)的比较:
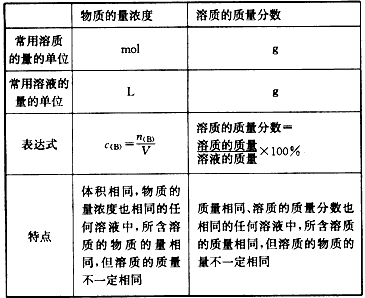
浓度计算的注意事项:
物质的量浓度(cB)=物质的量(n)/溶液的体积(V)
(1)V指溶液体积而不是溶剂的体积;
(2)取出任意体积的1mol/L溶液,其浓度都是1mol/L。但所含溶质的量则因体积不同而不同;
(3)“溶质”是溶液中的溶质,可以是化合物,也可以是离子或气体特定组合,特别的,像NH3、Cl2等物质溶于水后成分复杂,但求算浓度时,仍以溶解前的NH3、Cl2为溶质,如氨水在计算中使用摩尔质量时,用17g/mol。
溶液中溶质的质量分数与溶质的物质的量浓度的换算:
- 溶液中溶质的质量可以用溶质的质量分数表示: m(溶质)=ρ(g·cm-3)·V(L)·w% (1cm3=1mL)
- 溶液中溶质的质量可以用物质的量浓度来表示: m(溶质)=c(mol/L)·V(L)·M(g·mol-1)
- 由于同一溶液中溶质的质量相等,溶液的体积也相等,但注意:1L=1000mL,所以,上述两式可以联系起来:
ρ(g·cm-3)·1000V(mL)·w%=c(mol/L)·V(L)·M(g·mol-1) 化简得:1000ρw%=cM
发现相似题
与“如图是某学校实验室从化学试剂商店买回来的氢氧化钠试剂标签...”考查相似的试题有:
- 由铁、锌、镁、铝四种金属中的两种组成的10g混合物与足量的盐酸反应,反应后生成的氢气在标准状况下体积为11.2L.则混合物中...
- 为了除去工业废气中的SO2,防止造成环境污染,现查得一份将SO2转化为(NH4)2SO4的资料.摘要如下:“一个典型实验:初步处理...
- (1)在标准状况下,物质①4gH2,②33.6LCH4,③1molH2O,④3.01×1023个O2.含分子数最多的是(填序号,下同) ,含原子数最少的...
- 已知实验室中有一瓶失去标签的AgNO3溶液,取出其100mL溶液于烧杯之中,加入足量上述实验题中所配制的NaCl溶液,经反应完毕后...
- 在标准状况下,将224LHCl气体溶于635g水中,所得盐酸的密度为1.20g/cm3,试计算:(1)取出上述溶液10mL,稀释至60mL,其物质...
- 将标准状况下的aL HCl(g)溶于1 000g水中,得到的盐酸密度为bg·cm-3,则该盐酸的物质的量浓度是[ ]A.mol·L-1B.mol·L-1C.mol...
- 从1L 1mol•L-1的Na2SO4溶液中取出10mL溶液说法不正确的是( )A.该溶液浓度还是1mol•L-1B.该溶液含Na+数目是1L溶液中Na+数...
- 下列关于溶液的说法正确的是( )A.1L 0.2 mol/L CaCl2溶液中,Cl- 数目约为0.2×6.02×1023个B.50 mL 1mol/L AlCl3溶液与100...
- 今有0.1mol•L-1Na2SO4溶液300mL,0.1mol•L-1MgSO4溶液200mL和0.1mol•L-1Al2(SO4)3溶液100mL,这三种溶液中硫酸根离子浓度之...
- 在20℃时,将4.95g KNO3溶于10.0g水中,恰好配成密度为1.15g/cm3的饱和溶液,计算(1)此饱和溶液中KNO3的物质的量.(2)此饱...